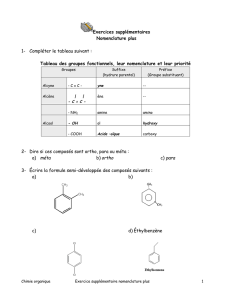
Cours 4-etudiant

Cours 4
Nomenclature
Organique et
Inorganique
Objectifs :
• Lire les informations contenues sur l’étiquette et la fiche signalétique
d’un produit dangereux
• Reconnaître les substances dans un article scientifique par exemple.

Nomenclature d’addition
2016-02-02 Nomenclature Inorganique
2
•2 parties classées par ordre croissant d’électronégativité
•Compare l’électronégativité d’un seul de ces atomes
•La molécule est toujours NEUTRE
CATION
Partie la MOINS électronégative
Charge positive
Pas de nom spécial
Partie la PLUS électronégative
Charge négative
Nom spécial :
Terminaison en "ure"
ANION
Exemple : chlorure de fer FeCl2
Électronégativité : Fe (1,83) Cl ( 3,16)
Le chlore est l’élément le plus électronégatif : anion → terminaison en ure !
Le fer est alors le cation

Formule chimique
2016-02-02 Nomenclature Inorganique
3
•Ordre croissant d’électronégativité
Cation + Anion
Composé Anion Cation
MgO O2- (3,44) Mg2+ (1,31)
NaF F- (3,98) Na+(0,93)
CaCl2 Cl- (3,16) Ca2+ (1,00)
CuSO4 SO4
2- Cu2+
La charge de cet ion
polyatomique est connue

Composés binaires SANS atome Métallique
2016-02-02 Nomenclature Inorganique
4
•Plusieurs atomes identiques :
utilisation d’un préfixe pour
indiquer le nombre
•Attention : Molécule est
neutre !!!!!!!!!
Nom de l’anion de nom du cation

Composés binaires AVEC atome Métallique
2016-02-02 Nomenclature Inorganique
5
•Cation = Métal
•Colonne 1 à 12
•Déterminer le nombre
d’oxydation du cation
•Indiqué à la fin du nom si
nécessaire en chiffre de
romain
•Déterminer le nombre d’atome
de chaque ion (pas d’utilisation
de préfixe) pour que la molécule
soit neutre
•Exemple :
•Mn2+ :
MnO Oxyde de manganèse (II)
•Mn3+ :
Mn2O3 Oxyde de manganèse
(III)
•Mn4+ :
MnO2 Oxyde de manganèse
(IV)
nom de l’anion de nom du cation (nombre d’oxydation)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
1
/
27
100%