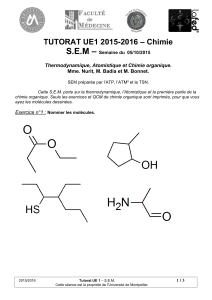
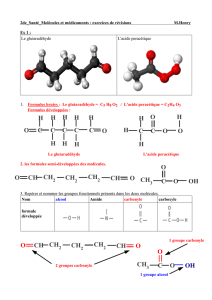
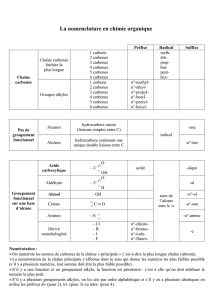
Nomenclature

CHIMIE ORGANIQUE
(Stage de pré-rentrée UE1)
Nomenclature des grandes
fonctions organiques

Objectifs
•Connaître les règles de nomenclature en chimie
organique.
•Distinguer les différents groupes fonctionnels
propres aux composés organiques.
•Avoir les bases nécessaires pour commencer à
aborder les différentes réactions.

Plan
•1. Généralités
•2. Nomenclature :
*Alcanes et radicaux
*Alcènes et allènes
*Alcynes
*Nomenclature du noyau benzénique
•3. Principales fonctions organiques:
*Dérivés Halogénés
*Alcools
*Ethers
*Aldéhydes et cétones
*Acides carboxyliques
*Esters et lactones
*Amines
*Amides et lactames
*Imines
*Nitriles
Fonctions oxygénées
Fonctions azotées

1. Généralités
•Chimie organique= Chimie des composés carbonés et hydrogénés.
•Peuvent contenir aussi : O, N, P, S
Halogènes (F, Cl, Br, I)
Alcalins et alcalino-terreux (+ rare)
→Ce sont les hétéroatomes.
•Par opposition, un hydrocarbure est un composé sans hétéroatomes.
•Les atomes sont liés entre eux par des liaisons covalentes simples
doubles ou triples

2. Nomenclature
•Alcanes ou Hydrocarbures saturés
Hydrocarbures ne contenant que des simples liaisons covalentes.
Molécule saturée : qui ne peut plus accueillir d’autres molécules par
addition. En fait, les carbones portent leur nombre maximum
d’hydrogènes (ils sont saturés).
Formule générale: CnH2n+2
Ex: CH4 = méthane (n=1)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%