Réactivité des alcools

Réactivité des alcools
Exercice 1
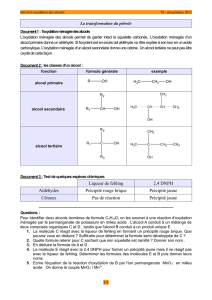
Préciser la classe des alcools suivants et donner la formule semi-développée des produits résultant de
leur oxydation ménagée.
CH3—CH2—OH CH3—CH2—CH2—OH CH3—CHOH—CH33-méthylbutan-2-ol
Exercice 2
On donne les noms des molécules obtenues par oxydation ménagée d'alcools. Donner la formule
semi-développée de chacun des alcools correspondants.
butanal acide butanoïque acide propanoïque
butanone propanone acide éthanoïque ou acide acétique
Exercice 3
On donne les formules semi-développées de l'acide lactique et de l'acide pyruvique:
acide lactique: acide pyruvique:
1. Préciser quels sont les groupes caractéristiques présents dans chacune de ces molécules.
2. Ces deux molécules sont associées dans un même couple. De quelle nature (acide/base ou
oxydant/réducteur) est ce couple? Quel est le rôle joué par chaque molécule dans ce couple?
3. Donner l'équation de la réaction d'oxydation de l'acide lactique par les ions permanganate en milieu
acide.
Exercice 4
On considère l'alcool dont le nom officiel est 5-méthyl-2-isopropylcyclohexanol (encore appelé
menthol) où l'atome d'indice 1 est l'atome de carbone fonctionnel et le groupe isopropyl est le groupe
donné ci-contre.
1. Donner la formule semi-développée du menthol.
2. Donner la représentation topologique de la menthone résultant de l'oxydation ménagée du menthol.
3. Écrire l'équation de la réaction d'oxydation du menthol par les ions permanganate en milieu acide.
4. Déterminer le rendement de la réaction de cette oxydation sachant qu'on a obtenu une masse
m=30,7g de menthone en oxydant m(al)=39,0g de menthol.
Donnée: Le rendement d'une transformation chimique est le rapport entre la quantité de matière du
produit réellement obtenue et la quantité de matière de produit que l'on aurait obtenue si la réaction
avait été complète.

Exercice 5
Actuellement, la proportion maximale d'éthanol autorisée dans l'essence est de 5% en volume.
On désire vérifier si un carburant est conforme à la législation en vigueur. Pour cela on traite une prise
d'essai de Vp=10,0mL de ce carburant par une solution de permanganate de potassium de
concentration C0=0,25mol.L-1 en milieu acide. L'éthanol contenu dans le carburant est oxydé en acide
éthanoïque (ou acide acétique). Il faut ajouter un volume V0=19,2mL de la solution de permanganate
de potassium pour obtenir une teinte rose persistante.
1. Écrire l'équation de la réaction entre l'éthanol et les ions permanganate en milieu acide.
2. Déterminer la quantité de matière d'éthanol contenue dans la prise d'essai.
3. En déduire la proportion en volume d'éthanol contenu dans le carburant étudié. Est-il conforme à la
législation?
Donnée: Masse volumique de l'éthanol: ?=0,79g.mL-1.
Exercice 6
On souhaite étudier le rendement de la préparation d'un alcène au laboratoire. Pour cela on réalise la
déshydratation d'une masse m=16,0g de méthylpropan-2-ol en présence d'acide sulfurique. Cette
réaction permet de recueillir un volume V=4,0L de l'alcène gazeux (le volume est mesuré dans les
conditions de l'expérience où Vm=25,0L.mol-1).
1. Sachant que l'acide sulfurique qui sert de déshydratant n'intervient pas dans le bilan réactionnel,
écrire l'équation de la réaction conduisant à l'alcène.
2. Déterminer la quantité de matière d'alcène obtenu.
3. Déterminer le rendement de cette préparation (voir exercice précédent).
1
/
2
100%