LM 15 Les transformations en chimie organique

Thème 2 :


I) Les aspects macroscopiques des transformations.
A) Les deux types de réactions
On distingue deux types de réactions chimiques :
•Les réactions de modification de la chaîne carbonée
•Les réactions de modification des groupes fonctionnels
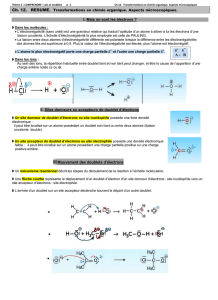
Les modifications de groupe fonctionnel
Réaction de reformage
avec la cyclisation de
l'hexane
Réaction d'oxydation ménagée
d'un alcool primaire

B) Les grandes catégories de réactions.
Les réactions d'addition
Les réactions d'élimination
Les réactions de substitution
La réaction d'addition
Une réaction d'addition est une réaction qui consiste à ajouter un
groupe d'atomes à une molécule en transformant une liaison double
en une liaison simple.
La réaction entre le but−2-ène et l'acide chlorhydrique est une réaction
d'addition appelée halogénation :

La réaction d'élimination
Une réaction d'élimination est une réaction au cours de laquelle deux groupes
d'atomes sont retirés d'une molécule. La réaction d'élimination est l'inverse de la
réaction d'addition.
Le 2-méthylpropan-1-ol subit une réaction d'élimination appelée déshydratation :
méthylpropène
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%