TS - WordPress.com

1
TS
Lycée Louis Massignon
2013-2014
STRUCTURE ET TRANSFORMATION DE
LA MATIERE
www.physiquechimie-llm.com
CHAPITRE 17 DEPLACEMENT
D’ELECTRONS EN CHIMIE ORGANIQUE
I .Comment déterminer la polarisation
d’une liaison
Electronégativité d’un élément
chimique
L’électronégativité est une grandeur sans
dimension qui traduit l’aptitude d’un atome
A à attirer à lui le doublet d’électrons qui
l’associe à un autre atome B par une liaison
covalente.
Dans la classification périodique, l’électronégativité augmente de la gauche vers la droite
d’une période (ligne et du bas vers le haut d’une colonne (famille.
Polarisation d’une liaison

2
Une liaison covalente entredeux atomes A
et B est polarisée (ou polaire) lorsqu’elle
relie deux atomes ayant une différence
d’électronégativité moyenne à forte, c’est à
dire comprise entre 0,3 et 2,0.
Une liaison covalente apolaire (non
polarisée ou non polaire) relie deux atomes
identiques ou deux atomes ayant une
différence d’électronégativité faible,
inférieure à 0,3. Le doublet d’électrons est
alors équitablement réparti entre les deux
atomes.
Une liaison ionique relie deux atomes ayant
une différence d’électronégativité très forte.
Le doublet d’électrons
est alors totalement
capté par l’atome le plus
électronégatif.
II. Sites donneurs ou accepteurs de doublet d’électrons
Site donneur de doublet d’électrons

3
Définition
Dans un édifice, un atome porteur de doublet(s) non liant(s) ou porteur d’une
charge électrique négative constitue un site donneur de doublets d’électrons.
Une liaison multiple constitue également un site donneur de doublet d’électrons.
Site accepteur de doublet d’électrons
Définition dans un édifice, un atome porteur d’une charge électrique positive
élémentaire constitue un site accepteur de doublet d’électrons.
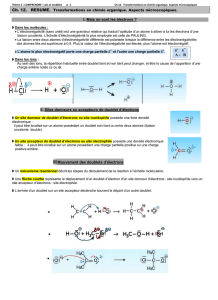
III. Mouvement d’un doublet d’électrons
Mécanisme réactionnel
Définition un mécanisme réactionnel décrit le déroulement, à l’échelle moléculaire
de chaque étape d’une transformation chimique, en particulier la nature des liaisons
formées et rompues, et l’ordre dans lequel se font ces formations et ces ruptures.

4
Modèle de la flèche courbe
La flèche courbe part d’un doublet d’électrons d’un site donneur et pointe vers un
site accepteur de doublets d’électrons.

5
1
/
5
100%