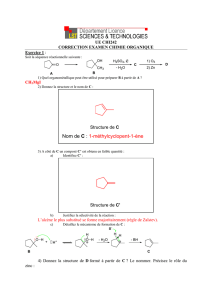
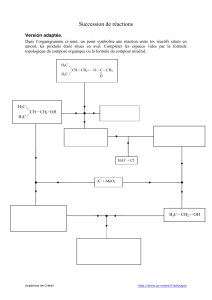
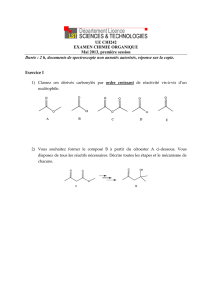
mécanisme réactionnel

Partie 2 : Chimie et développement durable
Synthèses chimiques :
Du macroscopique au microscopique dans
les synthèses
S.CALLEA
Lycée Gay-Lussac
Programme Term SPCL
23 Mai 2012

Programme de Terminale SPCL
Du macroscopique au microscopique dans les synthèse
Notions et contenus Capacités exigibles
Echelle
d’électronégativité
et
polarité
des liaisons
Nucléophilie,
électrophilie
et
réactivité
Mécanismes
réactionnels :
-
Étapes d’un mécanisme
-
Intermédiaires réactionnels
-
Catalyseurs
Ecrire les formules de Lewis des entités
chimiques
en
faisant apparaître les charges et les
charges
partielles
.
Prévoir les déplacements électroniques
possibles
des
sites nucléophiles vers les sites électrophiles.
Relier le formalisme des flèches représentant
le
déplacement
des doublets électroniques à
la
formation
ou àla rupture de liaisons dans les
étapes
d’un
mécanisme fourni.
Repérer, dans une étape du mécanisme,
les
réactifs
nucléophile et électrophile à l’aide
de
déplacements
des doublets électroniques.
Reconnaître dans un mécanisme une addition,
une
substitution,
une élimination et une réaction acide
-
base
Retrouver l’équation d’une réaction à partir
d’un
mécanisme
la modélisant au niveau microscopique.
Identifier un catalyseur dans un mécanisme fourni.
Montrer qu’un catalyseur renforce le
caractère
nucléophile
ou électrophile d’un site.

Commentaires du programme
Pas de réaction au programme
Aucun bilan n’est demandé. Les seuls bilans de
réaction au programme sont les réactions
étudiées en 1ère SPCL.
Le bilan de la réaction peut-être retrouvé à partir du
mécanisme donné
Interprétation des mécanismes à l’aide des flèches
courbes mais les réactifs, intermédiaires
réactionnels, les produits sont donnés.

Rappel des bilans des réactions de chimie organique à connaître 1ère SPCL
Réactivité des alcools :
R OH
R X
Oxydation des alcools
Substitution, nucléophile
Aldéhyde
Cétone
Acide carboxylique
Oxydant
(ex : MnO4-)
H+, Alcène Elimination
X

Rappel des bilans des réactions de chimie organique à connaître 1ère SPCL
Fonction alcool –Groupe hydroxyle
Oxydation
par KMnO4
et K2Cr2O7
Alcool primaire Acide carboxylique
5C
2H5OH(aq)+4MnO4-(aq)+12H+(aq)=5CH3COOH (aq)+ 4Mn2+(aq)+11H2O
Alcool secondaire Cétone
5C
3H8O(aq)+2MnO4-(aq)+6H+(aq)+=5C3H6O(aq)+ 2Mn2+(aq)+8H2O
Alcool tertiaire ne s’oxyde pas avec les oxydants usuels
Substitution
Elimination
Règle de Zaistev
H3CCH CH CH2
OH
H H
HC CH
H3C
CH3
HC CH
CH3
+
H3C
CH3
CH CH CH2
H
+O H
H
A B C
H+, +
minoritaire
ultramajoritaire majoritaire
H3C CH2
OH
=+O H
H
+HX
+-
H3C CH2
X
X = Cl, Br, I
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
1
/
54
100%