IRC_bio - Promotion Genesis

DIAGNOSTIC ET PRISE EN CHARGE DE
L’INSUFFISANT RENAL CHRONIQUE
•Dr SERVICE Aristide
•PH en Onco-Hématologie
•CHUM

DIAGNOSTIC ET SUIVI DE L’INSUFFISANT RENAL CHRONIQUE
1- Impact et Incidence en France de l’IRC
2- Définition –Physiologie et Physiopathologie
de l’IRC
3- Dépistage et diagnostic de l’IRC
3.1- Facteurs de risques
3.2- Examens cliniques et para-cliniques
3.3- Examens biologiques
4- Bilan d’extension
5- Suivi et Traitement du patient

Impact et Incidence en France de l’IRC
En France, l’IRC est un problème de santé publique ceci malgré les
efforts:
En terme de prévention primaire: traitement des angines, diminution de
certaines glomérulonéphrites, dépistage et traitement des reflux vésico-
urétraux chez l’enfant, restriction de l’utilisation de la phénacétine.
Mise en place d’expertise collective: Etude IRC 2000 mais qui proposait
peu de recommandations concernant le dépistage précoce en dehors
des populations à risque classique (diabétique de type II et sujets
hypertendus)
Mise en œuvre d’une Campagne Nationale en Octobre 2008
4,7% de la population adulte est atteinte d’IRC en Europe, en
France : 2 à 3 M de personnes souffrent d’IRC à différents stades
avec une augmentation de 5% par an (causes : HTA, Diabète,
Vieillissement de la population).
50 000 individus souffrent d’IRCT dont 33 000 dépendent d’une
méthode d’épuration extra-rénale (2% des dépenses de santé).
7 000 personnes/an atteignent le stade d’IRCT et 30% ne voit le
néphrologue qu’à ce stade
4/5ème des IRC décèdent de causes cardio-vasculaires

Définition de l’IRC
INSUFFISANCE RENALE CHRONIQUE
=
Diminution chronique de la filtration glomérulaire en rapport avec une réduction
permanente et définitive du nombre de néphrons fonctionnels
MALADIE RENALE CHRONIQUE (Définition de la National Kidney Fondation 2002)
Lésion rénale
Anomalies:
histologiques
Imagerie : échographie (polykystose, …)
Sédiment urinaire
Ionogramme, Ph urinaire
SPOT urinaire
OU
FG < 60 ml/min/1,73m2
Durée > 3 mois

Définition de l’IRC
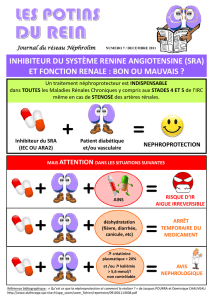
4 STADES DE LA MALADIE RENALE CHRONIQUE (ANAES 2002)
Stade 1 : Lésion rénale et DFG normale ou augmenté FG≥ 60ml/min/1,73m2
Stade 2 = IR modérée : DFG entre 30 et 59
Stade 3 = IR sévère : DFG entre 15 et 29
Stade 4 = IR terminale : DFG < 15
5 STADES DE LA MRC (National Kidney Foundation 2002)
Stade 1 : Lésion rénale et DFG normale ou augmenté FG≥ 90ml/min/1,73m2
Stade 2 : Lésion rénale et DFG entre 60 et 89
Stade 3 : DFG entre 30 et 59
Stade 4 : DFG entre 15 et 29
Stade 5 : DFG < 15
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
1
/
56
100%