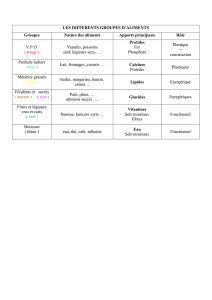
nettoyage sommaire

LE NETTOYAGE CHIMIQUE - SOMMAIRE
Définition
Les souillures .
Des glaises de toutes natures.
Des minéraux d'altération (carbonates sulfates - oxydes - hydroxydes).
Résidus organiques
Méthodes.
Précautions.
Le nettoyage selon la classe du minéral .
Les classes.
Propriétés chimiques des classes.
Les éléments natifs.
Les halogénures.
Les oxydes et hydroxydes.
Les sulfures et sulfosels.
Les sulfates chromates, molybdates et tungstates.
Les carbonates, nitrates et borates.
Les phosphates arséniates et vanadates.
La silice et les silicates.
Les réactifs. Leurs utilisations et leurs caractéristiques.
Les acides minéraux.
Les acides organiques.
Les bases.
Les réducteurs.
Les séquestrants.
Divers:
pHmétrie
Applications.
Les acides minéraux.
Acide chlorhydrique : HCI
Acide fluorhydrique : HF

Le mélange sulfochromique : H2S04 +
K2cr2o7
L'eau régale : HCI + HNO3
Les acides organiques.
L'acide formique HCOOH et l'acide
acétique 0H3-cooH.
L'acide oxalique (cooH)2
L'acide tartrique.
L'acide citrique.
Les bases.
La chaux.
La soude : NaOH
L'ammoniaque : NH4OH.
Les réducteurs.
Le dithionite ou hydrosulfite de soude :
Na2S2O4.
Le dioxyde de thiourée ou acide
formamido-sulfinique (NH2)(NH)CSO
(OH).
Le cyanure de potassium
Le sulfate d'hydroxylamine (NH2OH)2S04
ou le chlorhydrate d'hydroxylamine
(NH2OH)HCI.
Les tensioactifs ou détergents.
Les recettes :
Méthode de Pearl :
Méthode aux chromates.
Méthode aux acides organiques
Méthode de LEE
Méthode au bicarbonate.
Méthode de Sinkankas.
Méthode de Brannock.
Méthode de Foshag.
Méthode a l'acide oxalique.

Méthode au dithionite.
Méthode à l'eau oxygénée.
Une bonne recette pour un bon nettoyage
Le nettoyage des minéraux
(texte mis en ligne avec l'aimable autorisation de son auteur : Bernard BROCHIER)
Définition
La définition du dictionnaire est la suivante : rendre propre, net en débarrassant de tout ce
qui ternit ou salit.
Cette définition convient parfaitement aux traitements que nous devons infliger à nos
trouvailles pour mettre en évidence des facettes en éliminant les souillures de toutes
natures.
Les souillures
Lors de nos recherches et pérégrinations, il est très rare de trouver des échantillons
parfaitement propres, dans le meilleur des cas, l’échantillon sera terreux, mais la plupart du
temps, les pièces seront recouvertes de produits de dégradations de l'environnement
immédiat.
Des glaises de toutes natures.
Les glaises sont des résidus de dégradations minérales de granulométrie
voisine de la taille du micron, ceci pouvant expliquer le fait que les parties
élémentaires des glaises développent des surfaces de contact très
importantes donnant aux glaises cette structure "chewingum" qui est longue
à délayer et à éliminer.
Des minéraux d'altération (carbonates - sulfates - oxydes - hydroxydes).
Ce sont principalement des minéraux dérivés du fer (l'un des métaux le
mieux représenté sur terre) que l'on retrouvera sous forme d'oxydes et
d'hydroxydes plus ou moins carbonatés (limonite, hématite pulvérulente,
sidérite oxydée...). ou des minéraux dérivés du manganèse ou encore, selon
les gisements, des combinaisons de ces différents métaux. On rencontrera
aussi dans cette catégorie les encroûtements représentés par les carbonates et
les sulfates (calcite, gypse...) ou d'autres telle que la chlorite qui est une
altération de micas, pyroxène, amphiboles.
Des résidus organiques peuvent s'associer intimement, aux souillures minérales.
Ces différentes souillures nous conduiront à des processus de nettoyage qui nous
amèneront à utiliser des méthodes, des produits dangereux avec beaucoup de précautions,
tant au niveau du manipulateur que de la merveille que vous devrez mettre en valeur.
Méthodes
Le nettoyage ne peut s'envisager que de deux façons :
- Le nettoyage mécanique (qui va du simple souffle à des actions de décapage

beaucoup plus musclées tels que le sablage par exemple). Ces méthodes seront
détaillées dans un autre bulletin.
- Le nettoyage chimique qui agira par dissolution d'une partie ou de la totalité
des souillures.
Dans certains cas il est intéressant d'utiliser les propriétés chimiques de certains produits
qui se décomposent en provoquant des effervescences plus ou moins fortes qui peuvent
soulever les impuretés.
On aura souvent à réaliser plusieurs étapes de nettoyage en utilisant en alternance des
méthodes différentes.
Avant de rentrer dans le vif du sujet, il faudra se poser plusieurs questions.
Quel est le minéral à nettoyer ?
En effet selon la classe à laquelle il appartient, des enseignements sur sa
réactivité chimique et éventuellement sa fragilité mécanique seront forts
utils pour décider des traitements à appliquer.
Quels peuvent être les minéraux associés ?
Il peut être intéressant de savoir qu'avec le minéral principal de vos
échantillons se cachent, par exemple, sous les souillures, des aiguilles très
fines de rutile (fragilité mécanique) ou un cristal d'apatite qui disparaîtra
sans laisser de traces dans un bain acide (fragilité chimique).
Après ces quelques réflexions, il conviendra donc :
- De ne pas être pressé en ne brûlant pas les étapes et en rinçant bien entre
chaque étape car certains réactifs sont incompatibles. Plusieurs rinçages sont
parfois nécessaires afin de dessorber les réactifs qui ont pénétré dans les
fissures de la gangue. Un papier pH permettra de contrôler l'état de diffusion
des réactifs.
- De commencer simplement avec l'eau (attention aux minéraux solubles).
- De commencer sur un échantillon de moindre importance.
Pour résumer, un bon nettoyage commencera donc par :
- Un bain additionné d'un peu de détergent du type liquide vaisselle (éviter
les détergents ammoniaqués qui altèrent les minéraux à base de cuivre et
d'argent).
- Un rinçage à l'eau claire sous le robinet après un ou plusieurs jours de
trempage permettra d’éliminer une grosse partie de terre ou de glaise.
- Dans certains cas un nettoyage avec de l'eau sous pression ("Karsher"-
pistolet à peinture...) mené de façon contrôlée donnera des résultats
intéressants sans altérer les cristallisations.
Précautions
Les nettoyages ne se font que très rarement sans l'utilisation de produits corrosifs, toxiques

ou irritants. Les protections tels que gants caoutchouc, lunettes de protection, tablier ou
autres protections ont toutes leur importance.
Autant que possible, il faudra travailler dans un endroit ventilé. Lors d'utilisation d'acides
fumants ou de réactifs irritants, il sera bon de laisser mijoter les échantillons dans des
récipients hermétiques. Afin de préserver vos canalisations d'eaux usées, il sera nécessaire
de neutraliser les rejets acides. Des réactifs basiques tel que la chaux, la soude ou
l'ammoniaque ou des résidus calcaires ou de calcite apporterons une aide précieuse à la
protection de votre environnement.
Bien refermer vos flacons après usage (ils peuvent se renverser ou dégager des vapeurs
corrosives).
Obligez vous à étiqueter soigneusement vos produits pour les reconnaître et surtout éviter
des mélanges incompatibles dangereux voire mortels.
Maintenez hors de la portée des enfants et des animaux vos produits ainsi que vos
nettoyages en cours.
L'eau oxygénée concentrée (130 volumes ou plus) peut se décomposer plus ou moins vite
dans des récipients de propreté douteuse ou exposé à la chaleur, il sera alors opportun de ne
pas fermer le flacon de façon hermétique pour éviter son explosion.
Attention :
L'eau oxygénée à ces concentrations peut enflammer spontanément des graisses ou d'autres
matières combustibles.
Pour la sécurité des minéraux à nettoyer, éviter bien évidemment les cuvettes surchargées
(chocs mécaniques) ainsi que les chocs thermiques (nettoyage à chaud et rinçage à l'eau
froide), certains minéraux sensibles peuvent subir un choc en passant simplement d'un
local froid à un local chaud (fluorine).
Eviter les mélanges incompatibles tels que :
acides + eau de Javel => dégagement de chlore (irritant et très toxique)
acides + cyanure => dégagement d'acide cyanhydrique (mortel)
Le nettoyage selon la classe du minéral.
Selon leur classe, les minéraux ont des propriétés chimiques bien définies aussi
l'appartenance à telle ou telle catégorie nous orientera sur des précautions à prendre ou sur
des nettoyages bien spécifiques.
CLASSIFICATION PERIODIQUE DES ELEMENTS
H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Fe I Xe
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
1
/
24
100%