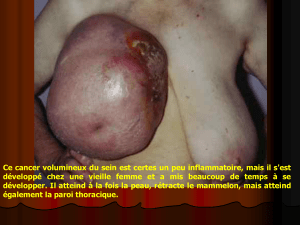
Reconstruction d`images de résonance magnétique à partir de l

Numéro d’ordre : 2007-ISAL-0055 Année 2007
Thèse
Reconstruction d’images de résonance magnétique à
partir de l’espace k partiel
Présentée devant
L’institut National des Sciences Appliquées de Lyon
Pour obtenir
LE GRADE DE DOCTEUR
Formation doctorale :
Images & Systèmes
Ecole doctorale :
Electronique, Electrotechnique et Automatique
Par
Josiane Adrienne YANKAM NJIWA
Soutenue le 5 Octobre 2007 devant la commission d’examen
Jury
Examinatrice
Membre Invité
Christine FERNANDEZ-MALOIGNE
Robert GOUTTE
Professeur
Professeur
Présidente Anne LEROY WILLIG Directeur de Recherche Inserm
Examinatrice Isabelle MAGNIN Directeur de Recherche Inserm
Rapporteur Su RUAN Professeur
Rapporteur Nicole VINCENT Professeur
Directeur de thèse Yue Min ZHU Directeur de Recherche CNRS
CREATIS-LRMN- UMR CNRS 5220-INSERM U 630
1

Reconstruction d’images de résonance magnétique à partir de
l’espace k partiel
Résumé
Dans le souci d’éviter les artéfacts que pourrait provoquer le mouvement sur les images, l’obtention
de temps d’acquisition de données courts est essentiel en imagerie par résonance magnétique (IRM).
En particulier, comme des sujets malades ont la plupart du temps des difficultés à retenir leur
respiration pendant l’examen, il devient par conséquent impératif de recueillir l’information nécessaire
le plus rapidement possible dans certaines études, telles que celles réalisées en imagerie cardiaque.
L’acquisition partielle des données de l’espace k est une pratique couramment utilisée dans le but de
diminuer le temps d’acquisition des données en IRM. La nécessité d'accélérer l’acquisition et/ou
d’augmenter la résolution spatiale des images en résonance magnétique nucléaire (RMN), a conduit à
la proposition de plusieurs méthodes de reconstruction qui acquièrent les données de l’espace k de
façon partielle, tant pour des objets statiques que pour des objets ou études dynamiques. Ces méthodes
utilisent des informations a priori (données acquises) pour retrouver celles manquantes.
Ce manuscrit présente trois méthodes de reconstruction IRM utilisant les données de l’espace k
acquises partiellement. La première méthode proposée est dédiée à la reconstruction d’objets ou
d’organes statiques, tandis que les deux autres sont consacrées à la reconstruction d’organes
dynamiques (application à l’imagerie cardiaque). Ces trois méthodes sont basées sur l’utilisation, dans
l’algorithme de reconstruction, du concept d’image analytique, combinée, dans le cas des images
statiques, à l’exploitation des redondances dans les données de l’espace k, et à l’utilisation des
redondances temporelles associées à la substitution des données, pour les organes en mouvement.
Ces méthodes ont été évaluées, dans le cadre de la reconstruction d’images statiques, par des
expériences sur des images simulées auxquelles a été rajouté un terme de phase pour la destruction de
la symétrie hermitienne. On a utilisé également des fantômes physiques ainsi que de vraies images de
cerveaux humains.
Les deux autres méthodes ont été évaluées par des expériences sur de vraies séquences de ciné
cardiaques humaines.
Le schéma de reconstruction proposé pour la reconstruction d’images statiques permet la réalisation
d’une réduction du temps d’acquisition d’un facteur de 2. En ce qui concerne les images dynamiques,
une réduction du temps d’acquisition d’un facteur de 4 a été réalisée, tout en maintenant une bonne
qualité de reconstruction, aussi bien qualitativement (aspect visuel, images de différence) que
quantitativement (bon rapport signal sur bruit, faibles valeurs d’erreurs).
2

Magnetic Resonance Image Reconstruction from Partial k-Space
Abstract
With the aim of avoiding the bad influence which the movement could have on the quality of the
images, short acquisition time is mandatory in magnetic resonance imaging (MRI). Especially for sick
patients who have problems holding their breath during examination, it becomes consequently
imperative to collect necessary information as faster as possible in certain studies, such as those
carried out in cardiac imaging. Partial k-space acquisition is a common way used to shorten the data
acquisition time in MRI applications. For the sake of short acquisition time and/or increased spatial
resolution of the reconstructed images, several methods have already been proposed, which partially
acquired the k-space data. These methods use a priori information to recover the missing data.
This manuscript presents three MRI reconstruction methods using partial k-space data. The first
proposed method is dedicated to the reconstruction of static objects or organs, while the two others are
devoted to the reconstruction of dynamic organs (application to cardiac imaging). These three
methods are based on the use, in the reconstruction algorithm, of the analytic image concept,
combined in the case of the static images with the exploitation of the redundancies in the k-space data,
and with the use of the temporal redundancies associated to the data substitution, for the moving
organs.
These methods were evaluated, within the framework of static images reconstruction, by experiments
on simulated images to which were added a slowly varying phase term to destroy the Hermitian
symmetry, and also on physical phantoms and true human brain images. The two other methods were
evaluated by experiments on true human cardiac sequences. The proposed reconstruction schema
allows achieving a reduction of the acquisition time by a factor of 2, for the static images
reconstruction. With regard to the dynamic images, a reduction of the acquisition time by a factor of 4
was carried out, while maintaining a good reconstruction quality, as well on visual meaning as
quantitative meaning (good signal to noise ratio, low error values).
3

ECOLES DOCTORALES DE L’INSA
SIGLE
INTITULE
NOM & COORDONNES DU
RESPONSABLES
CHIMIE
CHIMIE DE LYON
http://sakura.cpe.fr/ED206
INSA : R. GOURDON
Responsable : M. Jean LANCELIN
Université Claude Bernard Lyon 1
Bât CPE
Bât 308 - 2ème étage
43 bd du 11 novembre 1918
69622 VILLEURBANNE Cedex
Tél : 04.72.43.13.95
E2M2
ECONOMIE, ECOSYSTEME, MICROBIOLOGIE,
MODELISATION
http://biomserv.univ-lyon1.fr/E2M2/
INSA : S. GRENIER
Responsable : M. Jean-Pierre FLANDROIS
CNRS UMR 5558
Université Claude Bernard Lyon 1
Bât G. Mendel
43 bd du 11 novembre 1918
69622 VILLEURBANNE Cedex
Tél : 04.26.23.59.50 Fax : 04.26.23.59.49
e2m2@biomserv.fr
E.E.A.
ELECTRONIQUE,
ELECTROTECHNIQUE, AUTOMATIQUE
http://www.insa-lyon.fr/eea/
INSA : D BARBIER
Responsable : M. Alain NICOLAS
Ecole Centrale de Lyon
Bâtiment H9
36, avenue Guy de Collonge
69134 Ecully
Tél : 04.72.18.60.97 Fax : 04.72.18.60.83
EDIIS
INFORMATIQUE ET INFORMATIQUE POUR LA
SOCIETE
http://ediis.insa-lyon.fr/
Responsable : M. Alain MILLE
Université Claude Bernard Lyon 1
LIRIS-EDIIS
Bâtiment Nautibus
43 bd du 11 novembre 1918
69622 VILLEURBANNE Cedex
Tél : 04.72.42.44.82 Fax : 04.72.44.80.53
EDISS
INTERDISCIPLINAIRE SCIENCES-SANTE
http://www.ibcp.fr/ediss
INSA : M LAGARDE
Responsable : M. Didier REVEL
Hôpital cardiologique de Lyon
Bâtiment Central
28 Avenue Doyen Lepine
69500 BRON Cedex 07
Tél : 04.72.35.72.32
[email protected]lyon.fr
MATERIAUX DE LYON
http://www.ec-lyon.fr/sites/edml
Responsable : M. Jean Marc PELLETIER
INSA de Lyon
MATEIS
Bâtiment Blaise Pascal
7Avenue Jean Capelle
69621 VILLEURBANNE Cedex
Tél : 04.72.43.83.18 Fax : 04.72.43.85.28
Jean-marc.pelletier@insa-lyon.fr
MATH IF
MATHEMATIQUE ET INFORMATIQUE
FONDAMENTALE
http://www.ens-lyon.fr/MathIF/
Responsable : M. Pascal KOIRAN
Ecole Normale Supérieure de Lyon
46 allée d’Italie
69364 LYON Cedex 07
Tél : 04.72.72.84.81 Fax : 04.72.72.89.69
Pascal.koiran@ens-lyon.fr
MEGA
MECANIQUE, ENERGETIQUE, GENIE CIVIL,
ACOUSTIQUE
http://mega.ec-lyon.fr
Responsable : M. Jean Louis GUYADER
INSA de Lyon
Lab. de Vibrations et Acoustique
Bâtiment Antoine de Saint Exupéry
25 bis avenue Jean Capelle
69621 VILLEURBANNE Cedex
Tél : 04.72.18.62.14 Fax : 04.72.18.65.37
Jean-loius.guyader@insa-lyon.fr
SSED
SCIENCE DES SOCIETES DE L’ENVIRONEMENT
ET DU DROIT
INSA : J.Y TOUSSAINT
Responsable : Mme. Claude-Isabelle BRELOT
Université Lyon2
86 rue Pasteur
69365 LYON Cedex 07
Tél : 04.78.69.72.76 Fax : 04.37.28.04.48
Claude-isabelle.brelot@univ-lyon2.fr
4

à MOCHRI
‘ Il est des choses dont la gestion nous échappe, on se résigne tout simplement à s’en remettre
au Tout Puissant. C’est le cas pour moi en ce qui te concerne’
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
1
/
191
100%