B.a.-ba de la chimie organique
publicité
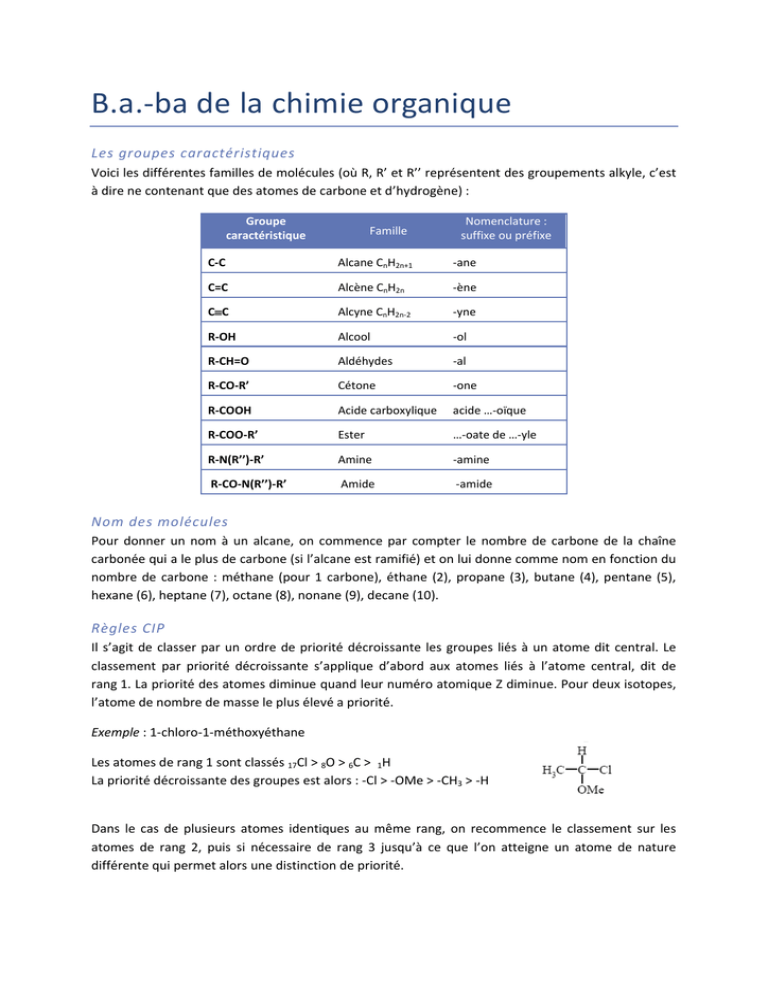
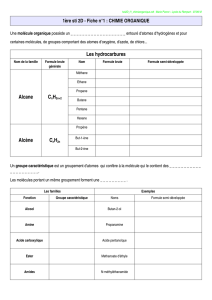
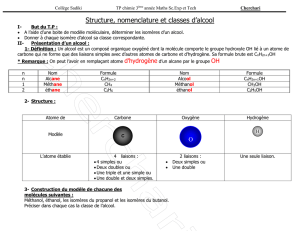
B.a.‐ba de la chimie organique Les groupes caractéristiques Voici les différentes familles de molécules (où R, R’ et R’’ représentent des groupements alkyle, c’est à dire ne contenant que des atomes de carbone et d’hydrogène) : Groupe caractéristique Famille Nomenclature : suffixe ou préfixe C‐C Alcane CnH2n+1 ‐ane C=C Alcène CnH2n ‐ène CC Alcyne CnH2n‐2 ‐yne R‐OH Alcool ‐ol R‐CH=O Aldéhydes ‐al R‐CO‐R’ Cétone ‐one R‐COOH Acide carboxylique acide …‐oïque R‐COO‐R’ Ester …‐oate de …‐yle R‐N(R’’)‐R’ Amine ‐amine R‐CO‐N(R’’)‐R’ Amide ‐amide Nom des molécules Pour donner un nom à un alcane, on commence par compter le nombre de carbone de la chaîne carbonée qui a le plus de carbone (si l’alcane est ramifié) et on lui donne comme nom en fonction du nombre de carbone : méthane (pour 1 carbone), éthane (2), propane (3), butane (4), pentane (5), hexane (6), heptane (7), octane (8), nonane (9), decane (10). Règles CIP Il s’agit de classer par un ordre de priorité décroissante les groupes liés à un atome dit central. Le classement par priorité décroissante s’applique d’abord aux atomes liés à l’atome central, dit de rang 1. La priorité des atomes diminue quand leur numéro atomique Z diminue. Pour deux isotopes, l’atome de nombre de masse le plus élevé a priorité. Exemple : 1‐chloro‐1‐méthoxyéthane Les atomes de rang 1 sont classés 17Cl > 8O > 6C > 1H La priorité décroissante des groupes est alors : ‐Cl > ‐OMe > ‐CH3 > ‐H Dans le cas de plusieurs atomes identiques au même rang, on recommence le classement sur les atomes de rang 2, puis si nécessaire de rang 3 jusqu’à ce que l’on atteigne un atome de nature différente qui permet alors une distinction de priorité. Exemple : 2‐éthyl‐2‐méthylpentan‐1‐ol Le classement global est donc : ‐C1H2OH > ‐C3H2‐C4H2‐C5H3 > ‐C1’H2‐C2’H3 > ‐C1"H3 Enfin, une liaison multiple est comptée comme autant de liaisons simples, ainsi chaque atome engagé dans une liaison multiple est répété autant de fois qu’il est lié dans cette liaison (éléments fantômes). Par exemple, le cas de la fonction aldéhyde : Propriétés physiques des énantiomères et diastéréoisomères Deux diastéréoisomères ont des propriétés physiques différentes (températures de changement d’état, densité…) et sont donc facilement séparables. Deux énantiomères ont toutes les propriétés physiques identiques à l’exception de leur pouvoir rotatoire (les énantiomères n’interagissent pas de la même façon sur une onde plane polarisée rectilignement). Deux énantiomères sont optiquement actifs et si le pouvoir rotatoire de l’un vaut α alors celui de l’autre énantiomère vaudra –α. Deux diastéréoisomères chiraux sont optiquement actifs. Il n’y a cette fois‐ci aucune relation entre leur pouvoir rotatoire. Si α = 0, soit la molécule est achirale, soit il s’agit d’un mélange racémique (mélange de deux énantiomères à 50‐50). Par exemple, l’acide mandélique :