LES GRANDE CLASSES DE COMPOSES ORGANIQUES

LES GRANDES CLASSES DE COMPOSES ORGANIQUES
I – Hydrocarbures
Indice d’insaturation d’un hydrocarbure (composé uniquement de Carbones et d’Hydrogène).
2
nbH composé saturé nbH composé réel
II
−
=
:
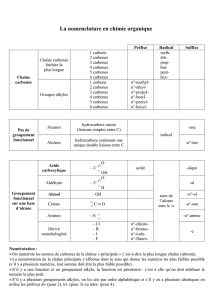
1) Alcanes et cycloalcanes
a. Alcanes C
x
H
2x+2
• Géométrie :
Carbones hydridés sp
3
Libre rotation autour des liaisons simples.
Ce sont des isomères de conformation
• Isomères :
Jusqu’à trois carbones, il y a un seul isomère.
A partir de 4 carbones, il y a plusieurs isomères.
butane / isobutane (méthylpropane) Isomères de squelettes
exemple : C
20
H
42
: 366319 isomères
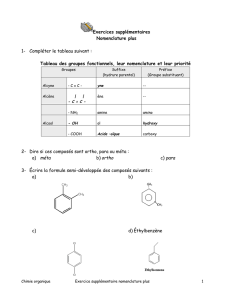
• Nomenclature : voir feuille correspondante
• Propriétés, sources, utilisations :
Alcanes linéaires : la température d’ébullition augmente avec le nombre de carbones (les
forces de London augmentent).
∆χ
C-H
faible > alcanes insolubles dans l’eau
Les alcanes servent comme solvant pour les graisses.
Réactivité très faible.
Sources d’alcanes : gaz naturel, pétrole…
Cire (beaucoup de carbones) naturelle : C
27
H
56
pouvoir anti-dessèchement

b. Cycloalcanes / C
x
H
2x
/ II = 1
• Géométrie :
Carbones hybridés sp
3
(109° en théorie entre les liaisons)
Formule topologique Nom Angle théorique Représentation réelle 3D
Cyclopropane 60°
Cyclobutane 90°
Cyclopentane 108°
Cyclohexane 120°
• Nomenclature : voir feuille correspondante
• Cycloalcanes fantaisie :
Cubane Basketane
2) Alcènes
• Géométrie :
Carbones hybridés sp
2
Pas de rotation possible autour de la double liaison
• Isomérie :
Isomères de position, de squelette et de configuration (stéréo-isomérie).
A B C D
A et B / A et C : isomérie de position
A, B et C sont des isomères de squelette de D

B et C : isomérie de configuration (stéréo-isomérie E/Z)
• Nomenclature : voir feuille correspondante
Exemples : (E)-5-méthylhept-2-ène
Cycles aromatiques :
Benzène Toluène Phénol Aniline Acide Benzoïque
• Propriétés, sources, utilisations :
Peu polaires > peu solubles dans l’eau
Grande réactivité des alcènes avec des espèces pauvres en électrons (électrons π mobiles).
Rôle biologique important.
CH
2
CH
2
éthylène : hormone de mûrissement des fruits
Polymères : PVC, polystyrène…
Polymère naturel : le caoutchouc.
3) Alcynes
• Géométrie :
Carbones hydridés sp > 4 atomes de carbonne linéaires
• Isomérie :
Isoméries de position et de squelette possibles.
Les hydrocarbures comportant des fonctions alcynes en bout de chaîne (R-1-yne) sont appelés
alcynes vrais. > réactivité intéréssante
–C≡C–H (hydrogène > acide)
δ
-
δ
+
• Nomenclature : voir feuille correspondante
• Propriétés, sources, utilisations :
Grande réactivité : utile pour rallonger des molécules (4 carbones minimum)
Acétylène présent dans le charbon > acide oxyacéthylénique après combustion.

II – Composés organiques possédant un hétéroatome
1) Composés halogènes
• Structure et isomères :
Carbones hybridés sp
3
, isomères de squelette et de position possibles.
R-CH
2
X composé halogéné (ou halogénure) primaire
R-CHX-R’ composé halogéné secondaire
R-CX(R")-R’ composé halogéné tertiaire
• Nomenclature : voir feuille correspondante
4-bromo-1-chloropentane
• Propriétés, utilisations :
- anesthésiants : CHCl
3
(chloroforme), C
2
H
5
Cl (chloroéthane)
- solvants : C
2
H
3
Cl
3
(1,1,1-trichloréthane) > nettoyage à sec
- réfrigérant : CFC (chlorofluorocarbones)
- insecticides : DDT : Cl
3
C-CH(C
6
H
5
Cl)
2
2) Composés oxydénés
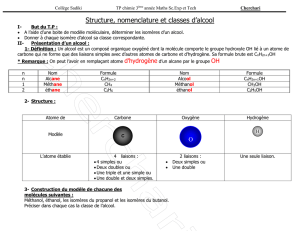
a. Alcools
• Structure, isomérie :
Carbones sp
3
> répulsion tétraèdre > géométrie coudée
R-CH
2
OH : alcool primaire
R-CHOH-R’ : alcool secondaire
R-C(R")OH-R’ : alcool tertiaire
• Nomenclature : voir feuille correspondante
• Propriétés, sources, utilisations :
Liaisons hydrogènes possibles > bonne solubilité dans l’eau pour un nombre de carbones peu
élevé. Réactivité élevée.
Température d’ébullition élevée.
Ethane M=30 Téb=-89°C
F-CH
3
M=34 Téb=-78°C
HO-CH
3
M=32 Téb=+64°C

Dans la nature : CH
3
OH (méthanol) > provoque la cécité
Exemple : l’aspartam libère du méthanol à 37°C
CH
3
-CH
2
OH (éthanol) > incolore, sans goût
b. Ethers
• Structure :
géométrie coudée
• Nomenclature : voir feuille correspondante
éther (ou oxyde de diéthyle ou éthoxyméthane ou diéthylether)
• Propriétés, sources, utilisations :
Plus de liaison hydrogènes intermoléculaires par rapport aux alcools, mais liaisons
hydrogènes faibles avec les alcools et l’eau.
oléane (hormone sexuelle chez les mouches > la molécule est chirale et les
deux isomères correspondent à l’hormone male et l’hormone femelle)
c. Composés carbonylés
• Structure :
O et C hybridés sp
2
> O (et ses orbitales), C (et ses liaisons) dans le même plan.
aldéhyde cétone
-CHO
bout de chaîne
• Nomenclature : voir feuille correspondante
benzaldéhyde cyclohexanecarbaldéhyde
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%