Couple acide-base : CORRECTION

Page 1
CORRECTION DES EXERCICES DU CHAPITRE n° 9
I) Analyse d’un alcool
a) Un mono alcool saturé a pour formule brute CnH2.n+1OH, où n est un nombre entier.
Sa masse molaire moléculaire est donc de la forme : M = 12.n + (2.n + 2).1 + 16 (g.mol−1).
D'après l'énoncé on a :
18n.14
n.12+ = 0,648, on en déduit : 12.n = 0,648.(14.n + 18)
Soit 12.n − 9,072.n = 18 ou 2,928.n = 11,664 d'où
n = 928,2 664,11 = 4
D'où la formule brute C4H10O ou C4H9OH
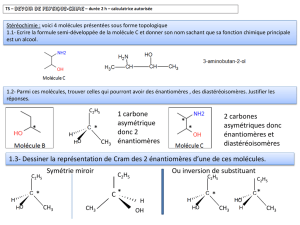
b) Les différents isomères du butanol peuvent s'écrire :
butan-1-ol
butan-2-ol
méthylpropan-1-ol
méthylpropan-2-ol
alcool primaire
alcool secondaire
alcool primaire
alcool tertiaire
c) L'oxydation ménagée de chacun de ces alcools donne respectivement :
C3H7 – CH2OH
→
C3H7 – CHO
→
C3H7 – COOH
butan-1-ol
→
butanal
→
acide butanoïque
alcool primaire
→
aldéhyde
→
acide carboxylique
C2H5 – CHOH – CH3
→
C2H5 – CO – CH3
butan-2-ol
→
butanone
alcool secondaire
→
cétone
CH3 – CHCH3 – CH2OH
→
CH3 – CHCH3 – CHO
→
CH3 – CHCH3 – COOH
méthylpropan-1-ol
→
méthylpropanal
→
acide méthylpropanoïque
alcool primaire
→
aldéhyde
→
acide carboxylique
Le méthylpropan-2-ol étant un alcool tertiaire ne donne aucun produit d'oxydation
ménagée.
II) Corps poly-fonctionnel
a) Ecrivons l'équation bilan de la réaction de combustion complète de A :
CxHyOz + (x +
4
y
−
2
z
) O2
→
x CO2 +
2
y
H2O
b) D'après l'équation on a :
1
n
A
=
x
n2
CO
=
y
n.2
OH
2
avec nA =
90
90,0
, nCO2 =
44
32,1
et nH2O =
18
54,0
La masse molaire moléculaire de A s'écrit : 12.x + y + 16.z = 90
On en déduit, d'une part x =
44
32,1
x90,090 = 3 et y = 2x
18
54,0
x90,090 = 6
Et d'autre part z =
16 612.390 −−
= 3
D'où la formule brute de A C3H6O3

Page 2
c) La coloration en jaune du bleu de bromothymol en présence de A met en évidence les
propriétés acides de ce corps.
Le corps A possède donc un groupe fonctionnel acide carboxylique :
On peut écrire : C2H5OCOOH
d) Le composé qui donne un test positif avec la D.N.P.H. et un test négatif avec la liqueur de
Fehling est une cétone.
e) Le corps A donne une cétone par oxydation ménagée :
A possède donc un groupe fonctionnel alcool secondaire
On peut écrire : CH3CHOHCOOH :
f) On en déduit la formule développée de A :
qui est l'acide 2-hydroxypropanoïque
III) Composés organiques monofonctionnels.
a) Un composé organique monofonctionnel saturé qui réagit avec la D.N.P.H. possède un
groupe carbonyle C = O qui peut se trouver dans un groupe :
- acide carboxylique – COOH de masse molaire 45,0 g.mol−1, le reste de la molécule ayant
une masse de 13,0 g.mol−1. Aucune molécule ne peut y correspondre.
- aldéhyde – CHO de masse molaire 29,0 g.mol−1, le reste de la molécule ayant une masse
de 29,0 g.mol−1. Avec une formule de la forme CnH2.n + 1, on trouve 12.n + 2.n + 1 = 29, d’où
14.n = 28 et n = 2. Soit une formule semi-développée : C2H5 – CHO
- cétone C = O de masse molaire 28,0 g.mol−1, le reste de la molécule ayant une masse de
30,0 g.mol−1. Avec une formule de la forme CnH2.n + 2, on trouve 12.n + 2.n + 2 = 30, d’où
14.n = 28 et n = 2. Soit une formule semi-développée : CH3 – CO – CH3
Le composé peut être : le propanal C2H5 – CHO ou la propanone CH3 – CO – CH3
b) Un composé organique monofonctionnel saturé qui ne réagit pas avec la D.N.P.H. ne
possède pas de groupe carbonyle C = O il peut s’agir d’un :
- alcane de formule brute CnH2.n + 2, soit 12.n + 2.n + 2 = 74, d’où 14.n = 72 et n = 5,14.
Aucune molécule ne peut donc correspondre.
- alcool de formule brute CnH2.n + 1OH soit 12.n + 2.n + 1 + 17 = 74, d’où 14.n = 72 et n = 4.
L’alcool est un butanol de formule brute C4H9OH.
Les isomères du butanol sont :
butan-1-ol
butan-2-ol
méthylpropan-1-ol
méthylpropan-2-ol
alcool primaire
alcool secondaire
alcool primaire
alcool tertiaire
- éther-oxyde de formule CnH2.n + 2O soit 12.n + 2.n + 2 + 16 = 74, d’où 14.n = 72 et n = 4.
On obtient 3 éther-oxydes de formule C4H10O.
méthoxypropane éthoxyéthane méthoxyméthyléthane
1
/
2
100%