10 - AMPCfusion

Pharmaco génétique des enzymes de phase 1 et 2
Quelques chiffres :
-3 a 7 % des patients hospitalisés en France à cause des EI (144000 hospitalisations),
cela représente 320 millions d’euros
-9% des hospitalisations aux USA
I) Les xénobiotiques
A) Définition
Un xénobiotique est une substance de faible poids moléculaire, et étrangère à la vie. On
distingue les médicaments, les polluants ainsi que les aliments
L’objectif de l’organisme est d’éliminer le xénobiotique (par les urines principalement,
rarement par la bile), cependant ils sont le plus souvent sous forme lipophile. Le
métabolisme permet de les transformer en substance hydrophile afin de faciliter leur
élimination.
B) Métabolisme des xénobiotique
On distingue trois grandes phases du métabolisme :
Phase 1 : fonctionnalisation
Phase 2 : conjugaison
Phase 3 : expulsion du xénobiotique (sous forme inchangée ou de métabolite en fonction
de sa nature).
C) Caractéristiques générales des EMX
On appelle EMX les Enzymes du Métabolisme des Xénobiotiques, ils sont classés en
superfamilles dans lesquelles on note de nombreuses isoformes. Celles ci sont
caractérisées par une grande redondance et une spécificité chevauchante. (Une EMX a
plusieurs substrats et un xénobiotique peut être le substrat de plusieurs EMX).
Les EMX peuvent avoir pour substrats des substances endogènes et exogènes (pour
lesquels ils sont peu efficaces).
On note une variabilité d’expression importante des EMX, celle ci est environnementale
et génétique, il existe de nombreux polymorphismes fonctionnels. Cette dernière donnée
est extrêmement importante en pharmaco, elle implique une susceptibilité individuelle
au médicament.
La phase I (fonctionnalisation), consiste à créer des groupement OH, NH2, COOH ou SH
pour rendre la molécule plus hydrophiles.

Les EMX concernée sont :
- Les mono-oxygénase : Flavine mono-oxygénases (FMO) et cytochromes P450 (CYP)
- Les estérases et les amidases
- Les oxydo réductases : Mono-amine oxydases, S-oxydases, Nitro-réductases
D) Exemple des cytochromes P450
Leur dénomination vient de « pigment 450 » étant donné qu’ils absorbent à 450nm.
La mono-oxygénase est couplée à une flavoprotéine du réticulum endoplasmique jouant
le rôle de réductase, la NADPH-réductase (qui joue donc le rôle de coenzyme).
Les cytochromes permettent le rajout d’un groupement OH sur le radical.
Les CYP sont des hémo-protéines, ils sont consitués d’un groupement prosthétique
(hème lié à un atome de fer) et d’un motif protéique. Ce motif est spécifique des CYP :
FxxGxxCxG, la cystéine est l’acide aminé qui permet la liaison à l’hème via son atome de
souffre. Ils sont fixé à la membrane du RE avec le NADPH.
Les CYP (Cytochromes P450) correspondent à une super-famille de cytochrome, celle ci
a pour origine plus de 500 gênes chez tous les êtres vivant. Chez l’homme, 57 isoforme
de CYP sont répartis dans 18 familles, elle-même comprenant des sous famille.
Les CYP 1, 2 et 3 sont les métaboliseurs des xénobiotiques, il faut surtout retenir les
CYP3 qu’on retrouve dans la métabolisation de plus de 50% de tous les médicaments.
CYP3A4 est une molécule que l’on rencontre très souvent dans le métabolisme des
médicaments.
Les CYP sont localisé majoritairement dans le foie, cependant on les trouve dans tous les
organes exposés aux xénobiotique : reins, poumons, tube digestif et cerveau.
La diversité́ des réactions et des substrats des CYP peut être expliquée par la réactivité́
des différents états d’oxydation du Fer et la nature du site actif de ces enzymes. Leur

régulation est indépendante pour chaque CYP, elle dépend de l’état nutritionnel, de
l’exposition préalable à des xénobiotiques et du terrain génétique.
L’objectif des réactions de mono-oxygénation des CYP est de créer des métabolites
hydrosolubles, cependant ces métabolites peuvent être plus réactifs que la molécule. Ces
métabolites peuvent réagir avec une protéine particulière, créant ainsi une toxicité
locale (souvent hépatocyte). Ils peuvent aussi se lié de manière covalente à l’ADN (on
parle de métabolite adduit à l’ADN), si celui ci n’est pas réparé cela peut engendrer des
cancers.
Les métabolites les plus réactifs sont les époxydes.
E) Expemple des UGT
Phase 2 : conjugaison.
Le but de la phase de du métabolisme est de rendre les substances plus hydrosolubles
mais moins réactives, la quasi-totalité des métabolites de phase 2 ne sont plus réactifs.
La principale enzyme mise en jeu est la Transférase, elle permet le transfert d’un
groupement endogène et hydrophile.
Principales reactions :
La réaction la plus courante est la glucuronoconjugaison, elle correspond au transfert
d’un acide glucuronique (dérivé du glucose) lui-même fixé sur un UDP, tout le
groupement transféré via une enzyme, l’UDP glucoronosyl transférase (UGT). Cette
réaction aboutit à la formation de métabolites hydrosolubles éliminés dans les urines.
Les substrats de cette enzyme sont des xénobiotiques fonctionnalisés, mais aussi
certaines substances endobiotique comme la bilirubine.

UGT est exprimée dans le foie, le rein les intestins et la peau. UGT1 et UGT2 sont
majoritaires même si on rencontre de nombreuses sous famille de cette enzyme.
Un Déficit en UGT1A1 est à l’origine du syndrome de gilbert, c’est une enzyme de
conjugaison de la bilirubine, son déficit engendre une hyperbilirubinémie.
Exemple de la métabolisation d’un xénobiotique : le paracétamol.
Cependant, si NAPQI est présent en trop grande quantité il va se lier des manière
covalente à des protéines hépatique et induit une toxicité locale. Le traitement est
l’acetylcystéine qui regénère le gluthation.
II) Varibilité de l’expression des EMX
L’expression des EMX dépend de nombreux facteurs :
-Environnementaux : Alimentation, médicaments, polluant.

-Endogènes : Démographiques, physio-pathologiques, génétiques
Ces différents éléments ont pour conséquence une grande variabilité de réponse à
l’exposition d’un xénobiotique. (Innéficacité, tolérance, toxicité ...)
Exemple du CYP2B6 : Ce cytochrome est sujet d’une grande variabilité individuelle
d’expression, 90% des individus exprime cette EMX et parmis eux la concentration peut
varier d’un facteur 20.
A) Variabilité environnementale
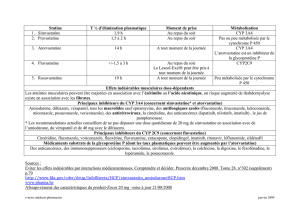
-Inhibition enzymatique : C’est la diminution de l’activité enzymatqiue, elle peut etre
réversible ou irréversible et est caractérisé par Ki. Elle peut être due à la compétivité de
deux substrats pour une EMX ou un transporteur et peut avoir pour conséquence des
interactions médicamenteuses : Exemple du jus de pamplemousse et des anti-
arythmiques ou du kétoconazole avec la ciclosporine. L’inhibition d’une enzyme peut
aussi se faire par repression de l’expression (effet transcriptionel).
-Induction enzymatique : elle résulte de l’augmentation de l’expression d’un gène
Variabilité physiopathologique (plus faible et moins importante):
Sexe : Peu de variations en fonction du sexe chez l’homme mais très importantes chez le
rat (essais cliniques)
B) Variabilité Physiopathologique
Pathologies : insuffisance hépatique (foie moins fonctionnel), inflammation : cytokines
(diminutions des cytochromes), diabète, cancers.
Age : fœtus (moins de CYP, autres isoformes, CYP3A7), vieillard (inhibition de
l’Induction). A partir de l’age de 2ans, les cytochromes sont tous fonctionnels chez
l’enfants.
Expression tissu-spécifique de certaines isoformes, exemple du Cyp1B1 dans le tissu
mamaire.
C) Variabilité génétique :
Les gênes codant les EMX peuvent être sujet de mutation rare modifiant le métabolisme.
Exemple du favisme dans le bassin méditerranéen, dans cette région on observe
couramment un déficit en G6PD qui peut conduire à cette maladie hémolytique.
 6
6
 7
7
 8
8
1
/
8
100%