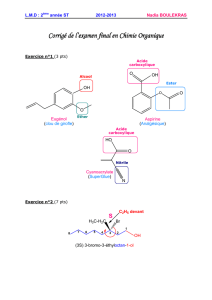
Alcools

Alcools, phénols et thiols 1
Alcools, phénols et thiols
I. Propriétés acido-basiques
1. Acidobasicité des alcools
a) Donner un ordre de grandeur des pKa d’un alcool.
b) Ecrire l’équation d’auto-protolyse de cet alcool.
c) Sous quelle forme se trouvent les alcools en solution aqueuse ? Les alcoolates
réagissent-ils avec l’eau ?
2. Influence de différents facteurs sur le pKa
a) Pourquoi le pKa augmente t-il avec la classe ?
b) A classe égale, quelle est l’influence de la longueur de la chaîne sur le pKa ?
c) Expliquer la différence de pKa entre les couples suivants :
– Phénol (pKa = 10) et cyclohexanol (pKa = 17).
– Métanitrophénol (pKa = 8,35) et Phénol (pKa = 10)
d) Pourquoi le paraméthylphénol est-il moins acide que le phénol ?
e) La première acidité du catéchol est plus forte que celle du phénol alors que la seconde
est plus faible. Pourquoi ?
OH
OH Catéchol
3. Comparaison avec les thiols
Le pKa de l’éthanethiol est de 10,5 alors que celui de l’éthanol est de 15,9. Comment
expliquer cette différence ?
II. Synthèse du MTBE
On cherche à obtenir le MTBE, oxyde de métyle et de tertiobutyle, additif à l’essence.
1. Première méthode
On peut tout d’abord envisager le le chauffage de méthanol et de méthylpropan-2-ol.
a) Quel catalyseur utiliser ?
b) Quels composés vont être obtenus ? Donner le mécanisme.

Alcools, phénols et thiols 2
2. Deuxième méthode
Le MTBE peut également être obtenu par synthèse de Williamson. Indiquer les
différentes étapes de cette synthèse, donner les mécanismes. Cette méthode est-elle
préférable à la première ?
3. Méthode industrielle
Par chauffage, en milieu acide, d’un mélange de méthanol et de méthylpropène.
Proposer un mécanisme et justifier la régiosélectivité.
III. Autres réactions des alcools
a) Quel est le principe du test de Lucas, quel en est l’intérêt ?
b) Comment passe t-on d’un alcool au dérivé halogéné correspondant ?
c) Expliciter les différentes méthodes d’oxydation des alcools, on fera intervenir la
classe de l’alcool, la nature de l’oxydant. Pour les réactions classiques, on mettra en
évidence l’aspect pratique par un schéma (lampe sans flamme notamment).
IV. Déshydratation intramoléculaire
Dans un bicol, on introduit 0,2 moles de 2-éthylcyclohexanol de densité 0,906, 15 mmol
d’acide phosphorique concentré et quelques morceaux de carborendum. L’ensemble est
porté à ébullition durant une demie heure. On sépare alors les phases organique et
aqueuse. On sèche la phase organique et on procède à un test au dibrome et au
permanganate qui s’avèrent tous deux positifs. Quelques microgrammes de la phase
organique sont prélevés pour effectuer une chromatographie en phase vapeur.
a) Quel volume d’alcool faut-il prélever ?
b) Qu’est-ce que le carborendum ? Quel est son rôle ?
c) Faut-il un réfrigérant ?
d) Donner le mécanisme de la réaction. En envisageant une transposition du
carbocation, combien de composés éthyléniques va-t-on obtenir ?
e) Donner le principe et le mécanisme des deux tests effectués.
f) Comment séparer les deux phases ? Comment et pourquoi sécher la phase
organique ?
g) Donner le principe de la chromatographie en phase vapeur. En supposant l’appareil
très performant, combien de pic présentera le chromatogramme ?
VII. Formation de carbocations et transposition
1. Formation des carbocations
Certains carbocations
R
sont en équilibre avec l’alcool à partir duquel ils ont été
formés :
RH2OROH H
La constante pKR+ de cet équilibre est donnée pour quelques carbocations :

Alcools, phénols et thiols 3
hP
hP
Ph
OH OH
O
HO
Ph3COH H3C
CH3
CH3
1234 5 6
Molécule
1
2
3
4
pKR+
3,2
4,7
–0,17
–6,44
a) Ecrire la formule des carbocations 1 et 2.
b) Ecrire, pour le carbocation 3, plusieurs formes limites de résonance.
c) Comparer la stabilité relative des carbocations 1, 2, et 4 à partir des valeurs des
constantes d’équilibre. Indiquer la raison essentielle de la forte stabilisation de certains
de ces carbocations. Justifier la réponse et en déduire la géométrie de l’ensemble de la
structure 2.
2. Evolution des carbocations
Le carbocation 5 peut évoluer en carbocation 6 par migration d’un hydrogène suivi de la
migration d’un groupement méthyle.
a) Comment nomme t-on ce phénomène ?
b) Lequel des deux carbocations est le plus stable ? Justifier votre réponse.
c) Ecrire le mécanisme d’obtention de 6.
3. Transposition pinacolique
Un exemple classique de cette transposition est donné par la conversion du 2, 3-
diméthylbutane-2, 3-diol (pinacol) 1 en méthylterbutylcétone (pinacolone) 2 en milieu
acide.
a) Le pinacol 1 est obtenu par réduction bimoléculaire de l’acétone par un amalgame de
magnésium dans un solvant anhydre, suivi d’addition d’eau au milieu réactionnel.
Proposer un mécanisme pour cette réaction sachant quelle débute par un transfert
monoélectronique sur l’acétone.
b) Proposer un mécanisme de la transposition pinacolique 1
2 catalysée par un acide.
c) Dans le cas des pinacols non symétriques, les résultats suivants ont été obtenus :
(CH3)2C
OH
C
OH
(CH3)2CH3C
O
C (CH3)2
12
– Pour chacune des réactions, écrire l’autre composé carbonylé qui aurait pu se
former.
– Interpréter la formation majoritaire des composés carbonylés indiqués (4 et 6).
– Montrer que, dans le cas particulier du composé 3, la réaction peut également
s’interpréter par une déshydratation suivie d’isomérisation.

Alcools, phénols et thiols 4
34
Ph2C
OH
CH2OH Ph2CHCHO
56
Ph2C(CH3) C
O
CH3
Ph2C
OH
C
OH
(CH3)2
1
/
4
100%