TP Microbiologie Etat frais - Milieu solide : une goutte d`eau + une

TP Microbiologie
Etat frais - Milieu solide : une goutte d’eau + une colonie
- Milieu liquide : une goutte du milieu
Entre lame et lamelle observé au microscope à l’objectif 40.
! Ensemencements
Milieu liquide : 5 à 10 gouttes de suspension d’un milieu liquide
A partir d’un milieu solide on prépare un tube à hémolyse avec de l’eau
physiologique soit on dépose quelques colonies avec l’ose.
Milieu solide :
Tubes : piqure centrale ou gélose incliné
Boites : - étalement en surface (râteau, 0,1ml)
-Inondation puis on enlève l’excès
-Incorporation (en masse) 1mL
-Isolement en surface (Méthodes des stries ou par épuisement) 0,1 ml
Dénombrement : voir TP2
N (UFC/ml) = Nombre de colonie (UFC) / Facteur de dilution (10-n) x Volume déposé (ml)
! Coloration de Gram
Réaliser un frottis : goutte d’eau, colonie avec l’ ose, sécher
1er colorant : Violet de gentiane (1min) puis rincer et sécher
fixateur : le lugol (1min), rincer et sécher
le différentiateur : alcool à 95° (5-10s), rincer et sécher
2ème colorant : fushine ou safranine (1min), rincer et sécher
observation à objectif X 100 avec une goutte d’huile sur la lame :
Violet = gram +, rose = gram _
noter la forme, le gram et l’arrangement des cellules.
Gram +, coques (staphylococcaceae + Streptocaccaceae)
Recherche de la catalase
Présence catalase (enzyme catalysant destruction des H2O2)
Test : On place quelque goutte d’ H2O2 sur un prélèvement de culture solide avec pipette pasteur.
Résultat : Catalase + dégagement gazeux avec mousse ou bulles (Staphylococcus)
Catalase - : Streptococcus
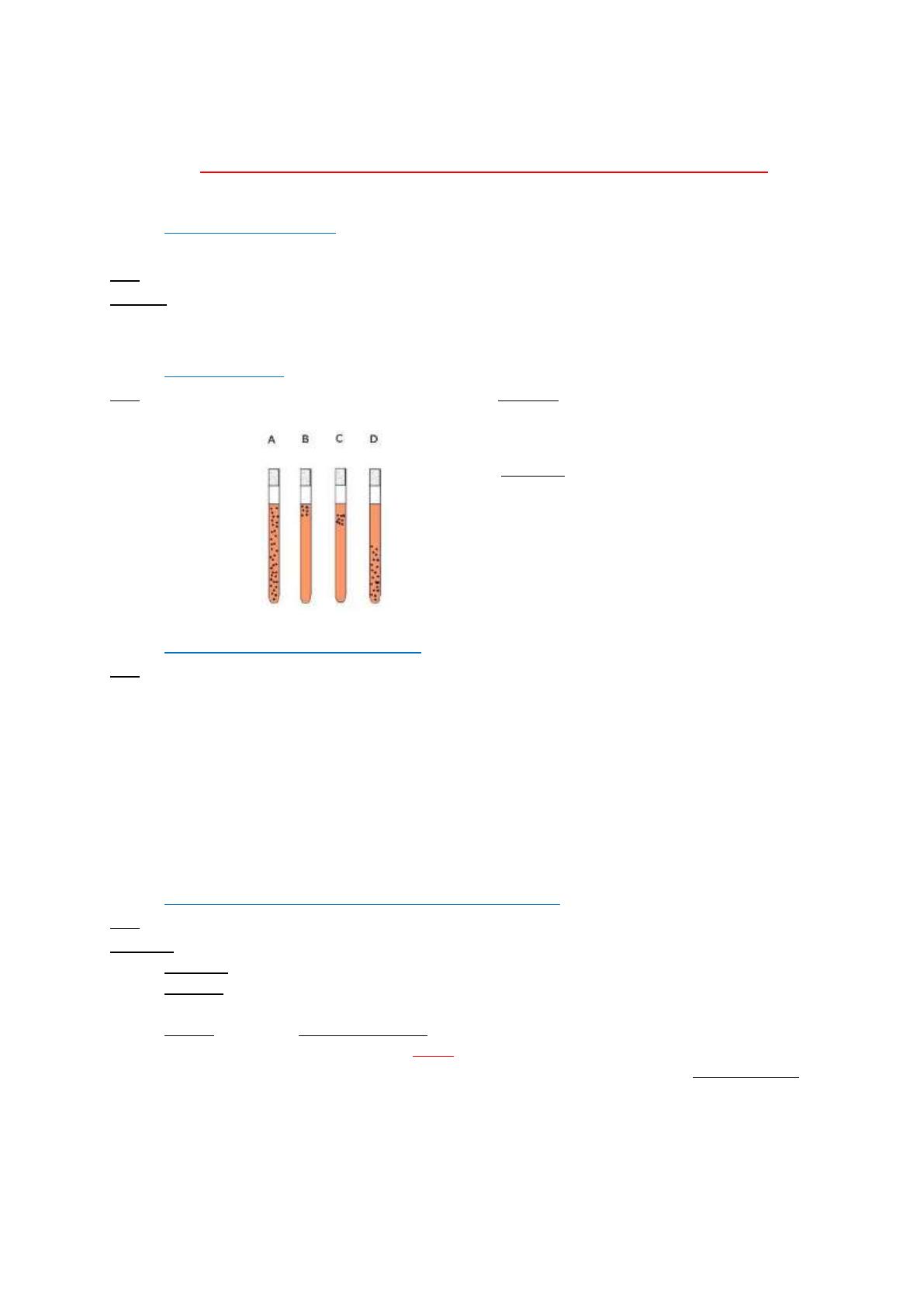
Type respiratoire (étude avec O2 de l’air)
Test : On utilise une gélose VF liquide : on ensemence en spiral avec une pipette pasteur et on refroidit à
l’eau froide (puis incuber à 37°C 24h)
Résultats :
A : aéro-anaérobie facultative
B : aérobie strict
C : micro-aérophiles
D : anaérobie strict
Métabolisme oxydatif ou fermentatif
Test : On utilise le milieu de Hugh et Leifson préalablement fondu au bain marie puis refroidie à 45°C.
On ajoute 0,5 ml de glucose (concentration finale 1%) puis on ensemence 2x2 tubes par piqûre centrale,
dont 1 sera fermé F car il sera recouvert d’huile de paraffine.
Oxydative: si O vert/orangé et F vert, elle utilise O2 et un peu acide.
Fermentative : si O et F jaune, pas utilisation O2 et très d’acide.
Inactive : si F et O vert, inactive pour le glucose et pas d’acide produit.
si O et F vert-bleu, elle est alcalinisant et on a un produit alcalin (basique).
Fermentation du mannitol, mobilité réduites des nitrates
Test : On utilise un milieu MMN ensemencé par piqûre centrale.
Résultats :
Mannitol : Mannitol + : Milieu devient jaune, fermentation du mannitol.
Mobilité : Mobilité - : Bactéries le long de la strie.
Mobilité + : partout.
Nitrate : On ajoute le réactif de Griess :
Réaction positive : coloration rouge, la bactérie réduit les nitrates en nitrites.
Réaction négative : pas de coloration, révéler les nitrates par ajout de poudre de zinc :
- Si coloration rouge la bactérie ne réduit pas les nitrates (présence de nitrites).
- Si pas coloration, pas de nitrate, pas de nitrites car déjà réduit en N2.

streptococcus
Présence d’une hémolysine (lyse hématies)
Test : On utilise une gélose au sang, on réalise une strie longitudinale.
Résultat : Zone verdâtre autour de la strie : Hémolyse α
Auréole claire autour de strie : Hémolyse
Aucune réaction : pas hémolyse
Croissance sur milieux hostiles
Test : -On ensemence une culture en milieu gélosé dans une solution de NaCl 6,5%.
- On ensemence une culture en milieu en solution pH 9,6.
Résultat : On apprécie la croissance (après incubation 5j à37°C).
*possibilité d’évaluer la croissance à différente T° (30min à 60°C).
Milieu sélectif :
BEA (bile- esculine-azide) : recherche de l’esculinase (bile et azide : inhibiteur)
Test : isolement sur BP BEA à partir de la culture en gélose (incuber à 37°C)
Résultat : esculine + : petites colonies translucide entouré d’un halo noir (réaction avec les ion Fe)
Esculine - : aucun changement
Milieu de slanetz et batley :
Test : isolement sur BP SB à partir de la culture en gélose (incuber à 37°C)
Résultat : si les colonies sont rose/rouge foncé se sont des streptocoques fécaux
staphylococcus
Présence d’une hémolysine (lyse hématies)
Test : On utilise une gélose au sang, on réalise une strie longitudinale.
Résultat : Zone verdâtre autour de la strie : Hémolyse α
Auréole claire autour de strie : Hémolyse
Aucune réaction : pas hémolyse
Présence de la thermonucléase
Test : On utilise une gélose à ADN dans une gélose 3 puits que l’on ensemence (témoin, froid et chaud)
Résultat : Puits chaud et froid différents : DNase non thermostable
Puits chaud et froid identique : DNAse thermostable (Staphylococcus aureus)
Dévellopement de colonie
et puits 2 et 3 rose ;
thermonucléase thermostable

Présence de la coagulase libre
Test : 0,5ml de culture 24h à 37°C sur bouillon cœur/cervelle à 0,5 ml de plasma de lapin
Agiter et incuber 24h à 37°C.
Résultat : Coagulase + : coagulation du contenu du tube. (Staphylococcus aureus)
Milieux sélectifs
Milieu de Chapman : Staphylococcus (Gram +)
Test : faire un étalement par épuisement par strie à partir d’une culture de 24h sur le milieu
(contenant NaCl qui permet la sélection de bactéries halophile et inhibe les autre).
Rouge de phénol dans le milieu permet de distingué les espèces. (incuber 24h à 37°C)
Résultat : Mannitol + : grosses colonies entourées d’une auréole jaune (fermentation mannitol) :
staphylococcus aureus
Mannitol - : pas petites colonies entouré de rouge
Milieu Baird parker : pour coagulase positive, il met en évidence la lécithinase et la lipoprotéinase
Test : à partir d’une culture de 24h ensemencé les BP par strie (incuber 24h à 37°C)
Résultat : -colonie noire : réduction du téllurite en téllure.
- halo claire : présence de protéolyse
-précipité blanc : hydrolyse des lécithines par lécithinase
Les staphylocoques coagulase + sont lécithinase + et protéolyse+

Gram +, bacilles (Lactobacillaceae)
Type de métabolisme (homofermentaire ou hétérofermentaire)
Test : On ensemence un milieu liquide MRS (Man, Rogosa, Sharpe) + cloche de Durham
Résultat : Hétérofermentaire : production de CO2 : présence de gaz sous la cloche.
Température de croissance
Test : On ensemence 3 milieux MRS qu’on incube à différentes températures.
Recherche de l’arginine dihydrolase : ADH pour bactéries en anaérobiose
Test : On ensemence un milieu liquide de Möller à l’arginine qui sera recouvert de parrafine.
Résultat : Positif : croissance et coloration pourpre (enzyme dégrade arginine)
Négatif : coloration jaune
Recherche de l’esculinase
Test : On ensemence pour piqure centrale une gélose à l’esculine.
Résultat : Positif : milieu noir (la bactérie possède l’enzyme esculinase)
Négatif : milieu reste gris
Fermentation des glucides
Test : Dans un milieu viande levure, on ajoute 1 mL de solution de glucide puis on ensemence avec
la culture 24h et incubation 30°c 5j).
Résultat : fermentation + si virage de l’indicateur de pH.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%