Version du 14/02/2013

1
CANCEROLOGIE MOLECULAIRE : LES NOUVEAUX OUTILS DU
PATHOLOGISTE
Jean-Yves SCOAZEC
Services de Pathologie Morphologique et Moléculaire, Département de Biopathologie,
Gustave Roussy, Villejuif ; Unité « Analyse moléculaire, modélisation et imagerie de la
maladie cancéreuse », CNRS UMS3655/INSERM US23, Villejuif
L’analyse d’échantillons tissulaires ou cellulaires, obtenus par ponction, biopsie, résection
endoscopique ou chirurgicale, joue un rôle clé en cancérologie. L’examen de ces échantillons
est de la compétence des anatomopathologistes, plus souvent et plus simplement appelés
aujourd’hui « pathologistes ». Les applications de l’analyse tissulaire (ou cellulaire) en
cancérologie sont multiples : pour le diagnostic d’abord (rappelons que la preuve même de
l’existence d’un cancer repose sur l’examen anatomopathologique), mais aussi pour
l’évaluation du pronostic et l’établissement du stade de la maladie. Le développement récent
de la biologie moléculaire, puis des thérapies ciblées a élargi le champ d’application des
techniques morphologiques appliquées aux échantillons cellulaires et tissulaires: il est courant
aujourd’hui de devoir mettre en évidence des marqueurs « moléculaires » pour affirmer un
diagnostic ou prédire la réponse (ou la résistance) à un traitement avant sa prescription initiale
ou durant son suivi.
Pour faire face aux nouveaux besoins des cancérologues, mais aussi pour transposer dans leur
pratique les avancées considérables de la biologie du cancer, les pathologistes ont dû adapter
leurs méthodes et s’approprier de nouvelles techniques d’analyse. Ces nouvelles techniques
viennent habituellement compléter des techniques plus anciennes et plus éprouvées. L’objectif
de ce cours est de mettre en évidence cette évolution rapide et de présenter la nouvelle boîte à
outils des pathologistes et ses applications potentielles.
La nouvelle boîte à outils du pathologiste
Bien que les techniques morphologiques se soient considérablement enrichies depuis une
trentaine d’années, il ne faut pas pour autant négliger les techniques traditionnelles qui
conservent encore, pour l’instant, un rôle clé dans le diagnostic et l’évaluation pronostique.
C’est ainsi que l’examen microscopique, ou histologique, conventionnel reste l’outil à la fois

2
le plus simple, le plus puissant et le moins coûteux pour obtenir un grand nombre
d’informations utiles. En pathologie, il est indispensable, et souvent suffisant, pour réaliser la
plupart des diagnostics. Cet examen peut désormais être complété et précisé par les
nombreuses techniques cmplémentaires à al disposition du pathologiste.
L’un des atouts majeurs de ces techniques est de permettre l’analyse in situ du flux
d’informations qui va des gènes aux protéines et qui constitue l’axe majeur de la biologie,
notamment de la biologie du cancer, depuis plusieurs décennies :
- l’immunohistochimie, pour la mise en évidence de protéines spécifiques,
- l’hybridation in situ, pour la mise en évidence des acides nucléiques, dont les ARN
messagers,
- la cytogénétique moléculaire in situ, incluant la FISH (fluorescent in situ
hybridization) et ses variantes comme la SISH (silver enhanced in situ hybridization)
et la CISH (chromogen in situ hybridization), qui permet la mise en évidence de
segments chromosomiques contenant des gènes d’intérêt.
L’immunohistochimie est depuis longtemps incontournable en diagnostic comme en
recherche. Son intérêt majeur est de donner en un seul temps plusieurs informations
importantes sur le profil d’expression d’une protéine : est-elle détectable ou non ? dans quels
tissus et dans quelles cellules est-elle présente ? dans quel compartiment cellulaire est-elle
localisée ? La limite principale de l’immunohistochimie réside dans la difficulté de
quantification des résultats, qui ne peuvent au mieux être exprimés que sous forme semi-
quantitative et encore, avec beaucoup de précautions ; le développement de tehcniques de
quantification automatisée, par analyse d’images, est une de spistes d’avenir. Une autre limite
est que l’immunohistochimie renseigne sur la présence ou l’absence d’une protéine, mais pas
sur son état fonctionnel, sauf dans des cas particuliers où des anticorps adaptés peuvent être
utilisés.
Les applications de l’immunohistochimie sont multiples: (a) identification de lignées
cellulaires spécifiques, notamment lorsque les critères utilisés habituellement pour
l’identification morphologique sont absents ou peu sensibles (comme pour l’identification des
lignées lymphocytaires), ne sont pas utilisables (notamment en pathologie du développement,
aux phases initiales de l’émergence des populations cellulaires) ou lorsqu’ils sont pris en
défaut ou altérés (notamment en pathologie tumorale) ; (b) identification de marqueurs
diagnostiques, pronostiques ou prédictifs de la réponse à un traitement ; (c) identification des
conséquences phénotypiques d’altérations génomiques ; (d) screening pour la détection

3
d’anomalies génétiques qui seront ultérieurement déterminées par les techniques de biologie
moléculaire.
A la différence de l’immunohistochimie, l’hybridation in situ est restée d’un usage limité en
cancérologie. Cette technique, contrairement aux techniques immunohistochimiques, est de
standardisation et d’automatisation difficiles. La sensibilité est souvent faible, à moins
d’utiliser des techniques de révélation radioactives, ce qui pose des problèmes importants de
logistique. Pour ces diverses raisons, les indications en diagnostic sont peu nombreuses,
limitées à la détection d’ARN présents en grande abondance, dont les ARN viraux (comme
dans le cas des tumeurs liées à l’EBV).
Contrairement à l’hybridation in situ, la cytogénétique moléculaire in situ a rapidement
conquis une place importante en cancérologie, car elle permet la mise en évidence directe
d’altérations génomiques utiles comme marqueurs diagnostiques ou prédictifs. Les techniques
de FISH (ou leurs alternatives non fluorescentes) permettent de détecter in situ des
amplifications géniques (comme dans le cas de HER2 dans le cancer du sein ou de MET dans
plusieurs types de tumeurs) ou des translocations spécifiques (comme dans de nombreux
lymphomes, plusieurs exemples de sarcomes et de tumeurs pédiatriques ou dans le cancer du
poumon). Ces anomalies sont essentielles pour le diagnostic : c’est ainsi que la classification
des sarcomes et des tumeurs pédiatriques est devenue aujourd’hui autant moléculaire que
morphologique. D’autres sont des marqueurs théranostiques, comme l’amplification de HER2
dans le cancer du sein et les translocations impliquant ALK ou ROS1 dans le cancer du
poumon.
Le pathologiste et le biologie moléculaire
Les biologistes moléculaires ont réalisé l’importance et la richesse des informations contenues
dans les échantillons tissulaires et cellulaires et ont développé des techniques adaptées pour
l’extraction et l’analyse des acides nucléiques à partir d’échantillons frais, congelés ou fixés.
Pour être efficace, ce qu’il est convenu d’appeler la pathologie moléculaire nécessite
l’association étroite entre pathologistes et biologistes moléculaires, les premiers maîtrisant la
phase préanalytique, les seconds la phase analytique et les deux contribuant à l’interprétation
des résultats.
Les tehcniques sont aujoud’hui très diversifiées. Des techniques de PCR ou de séquençage
conventionnel ont été utilisées pour la mise en évidence de mutations ponctuelles, notamment
dans des oncogènes. Ces anomalies ont été utilisées comme marqueurs diagnostiques mais
surtout théranostiques dans divers types de tumeurs solides: mutations de KIT et PDGFRA

4
dans les GIST, de k-ras et b-raf dans le cancer du côlon et le mélanome, d’EGFR dans le
cancer du poumon … Le développement des techniques de séquençage de nouvelle
génération (NGS) permet de réaliser aujourd’hui l’étude simultanée de pannel de gènes à
partir d’un seul échantillon. Il est également possible de réaliser des analyses d’exomes
complets, des techniques de RNASeq et de CGH à partir d’échantillons tissulaires, voire
cellulaires. Les champs d’application des techniques de biologie moléculaire se sont donc
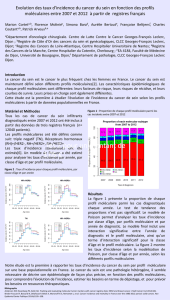
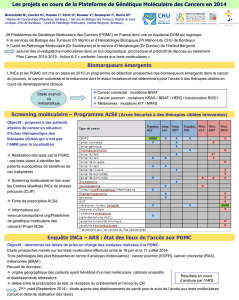
considérablement élargis en l’espace de quelques années. Rappelons qu’en France, ces
techniques sont actuellement réservées aux plateformes de génétique moléculaire du cancer
labellisées par l’Institut National du Cancer. Le défi réside désormais dans les capacités
bioinformatiques d’analyse des résultats et dans la capacité des bioinformaticiens d’établir des
interactions avec les pathologistes.
Pour répondre aux besoins des biologistes moléculaires, les pathologistes ont dû adapter leurs
techniques de conditionnement et de préparation tissulaires (et cellulaires) à de nouvelles
exigences : il s’agit non plus seulement de répondre à leurs propres besoins, mais aussi de
répondre aux besoins de ces nouveaux partenaires. Les morphologistes ont (re)découvert à
cette occasion le rôle clé de la phase « pré-analytique » … Des techniques nouvelles ont été
développées, comme la microdissection tissulaire (3, 4). La microdissection permet
d’améliorer la sensibilité et la spécificité des analyses moléculaires : son principe est de
sélectionner in situ, dans un tissu complexe ou hétérogène, les cellules d’intérêt, puis de les
isoler (généralement par l’intermédiaire d’un découpage laser) et enfin de les recueillir
spécifiquement. La microdissection est souvent combinée avec des approches génomiques ou
transcriptomiques, mais peut aussi se combiner avec des techniques d’analyse protéomique
(5).
Gérer les tissus comme des ressources biologiques : les nouvelles tâches du
morphologiste
Pour permettre, y compris à d’autres que lui, de tirer le maximum d’informations d’un
échantillon tissulaire ou cellulaire, un morphologiste doit désormais savoir :
• préserver et conditionner, voire préparer, les tissus de manière adaptée pour la
réalisation de techniques d’investigation morphologiques ou non morphologiques,
• collecter, qualifier et annoter des échantillons tissulaires,
• constituer et gérer des collections d’échantillons.
Le conditionnement des échantillons tissulaires sont devenus cruciaux pour la faisabilité et la
qualité des investigations ultérieures (6). Le morphologiste doit maîtriser la durée qui s’écoule

5
entre le prélèvement initial et le conditionnement de l’échantillon. Il doit savoir choisir le
conditionnement le plus adapté au projet envisagé : cryopréservation, qui conserve les
constituants moléculaires mais altère la structure, ou fixation, qui préserve la structure mais
altère les constituants moléculaires. Il doit savoir recourir à d’autres techniques de
conditionnement, comme la dessication, pour répondre à des besoins spécifiques.
Le pathologiste doit également savoir contribuer à la constitution et à la gestion de collections
d’échantillons tissulaires ou cellulaires, susceptibles d’entrer dans ce qu’il est convenu
d’appeler un centre de ressources biologiques (7). Le principe est de collecter, conserver et
mettre à disposition des échantillons tissulaires ou cellulaires, associés à des informations
pertinentes et utiles sur l’échantillon lui-même et sur la source dont il provient, dans le respect
des règles éthiques et sous le contrôle de procédures qualité.
Conclusion et perspectives
Beaucoup de changements sont survenus dans les outils, les techniques, les activités mêmes
des pathologistes. Les techniques se sont enrichies et diversifiées, les besoins sont devenus
plus exigeants, les pathologistes ont dû apprendre à participer à des processus collectifs,
impliquant divers partenaires. D’autres évolutions sont à prévoir pour répondre à de nouveaux
besoins: citons comme exemples le développement d’approches intégrées, combinant
analyses moléculaires et phénotypiques (ce qu’il est convenu d’appeler la protéogénomique),
l’analyse des paramètres fonctionnels et métaboliques, l’analyse de la réponse immune
(combinant cytométrie de flux, immunohistochimie et analyse d’images) …
REFERENCES
1. SCOAZEC JY: Tissue and cell imaging in situ: potential for applications in pathology and endoscopy. Gut,
2003, 52 Suppl 4, 1-6.
2. ABATI A, FETSCH P, FILIE A: If cells could talk. The application of new techniques to cytopathology. Clin.
Lab. Med., 1998, 18, 561-583.
3. MURRAY GI: An overview of laser microdissection technologies. Acta Histochem., 2007, 109, 171-176.
4. DECARLO K, EMLEY A, DADZIE OE, MAHALINGAM M: Laser capture microdissection: methods and
applications. Methods Mol. Biol., 2011, 755, 1-15.
5. XU BJ: Combining laser capture microdissection and proteomics: methodologies and clinical applications.
Proteomics Clin. Appl., 2010, 4, 116-123.
6. PLENAT F, MONTAGNE K, WEINBRECK N, CORBY S, CHAMPIGNEULLE J, ANTUNES L, BONNET
C, MAIRE C, MONHOVEN N: Les conséquences moléculaires de la fixation et de l'inclusion: exemple des
acides nucléiques et des protéines. Ann. Pathol., 2006, 26, 8-21.
7. HEWITT RE: Biobanking: the foundation of personalized medicine. Curr. Opin. Oncol., 2011, 23, 112-119.
1
/
5
100%