UE3- DVL-SNC (word)

1
UE 3 – Dr. Do Van Lanh
Pharmacologie des systèmes : système nerveux
central
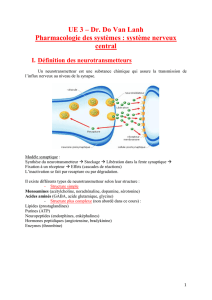
I. Définition des neurotransmetteurs
Un neurotransmetteur est une substance chimique qui assure la transmission de
l’influx nerveux au niveau de la synapse.
Modèle synaptique :
Synthèse du neurotransmetteur Stockage Libération dans la fente synaptique
Fixation à un récepteur Effets (cascades de réactions)
L’inactivation se fait par recapture ou par dégradation.
Il existe différents types de neurotransmetteur selon leur structure :
- Structure simple
Monoamines (acétylcholine, noradrénaline, dopamine, sérotonine)
Acides aminés (GABA, acide glutamique, glycine)
- Structure plus complexe (non abordé dans ce cours) :
Lipides (prostaglandines)
Purines (ATP)
Neuropeptides (endorphines, enképhalines)
Hormones peptidiques (angiotensine, bradykinine)
Enzymes (thrombine)

2
II. Neuromédiateurs centraux
1. Substances neurotransmettrices au niveau du système
nerveux central
Ici on a un schéma avec les neurotransmetteurs qu’on retrouve au niveau central. On a deux
groupes :
- Ceux qui vont effectuer une transmission directe, rapide, effet de type tout ou rien (à
gauche). On aura une ouverture et fermeture des canaux ioniques.
- Ceux qui vont provoquer des effets modulateurs un peu plus lents (à droite), avec une
action indirecte : ils vont réguler la transmission par l’intermédiaire de seconds messagers. Ce
sont par exemples de neuropeptides et des monoamines.
Acides aminés à connaître :
Le glutamate est le principal neurotransmetteur excitateur au niveau de système
nerveux central. Il agit en dépolarisant les neurones et en augmentant la conductance
membranaire en Na+.
Le GABA est le principal neurotransmetteur inhibiteur. Il agit en hyperpolarisant les
neurones et en augmentant la conductance membranaire en Cl-.
La glycine est aussi un neurotransmetteur inhibiteur. Elle est principalement dans la moelle
épinière.
Les neuropeptides interviennent plus au niveau de la douleur, mais on ne va pas vraiment en
parler. Il faut savoir que la plupart des médicaments qu’on utilise pour le système nerveux
central peuvent provoquer des problèmes de dépendance.

3
2. Exemple de neurotransmetteurs et pathologies impliquées
Voici les principaux neurotransmetteurs impliqués dans les pathologies.
Le GABA est impliqué dans l’épilepsie, Huntington, et aurait une action aussi dans
l’anxiété.
III. Acides aminés et pathologies associées
1. Epilepsie
A. Définition & Généralités
L’épilepsie est une décharge hyper synchrone des neurones de l’ensemble ou d’une partie
limitée du cortex.
Il y a différentes formes d’épilepsie :
- L’épilepsie généralisée (celle qu’on connaît le plus) est caractérisée par une crise tonico-
clonique de type grand mal durant plusieurs minutes. Elle possède 3 phases :
- Une phase tonique caractérisée par morsure de la langue
- Une phase clonique traduit par alternante contraction-décontraction des
muscles.
- Une phase de résolution ou le sujet tombe dans un coma profond, s’urine
dessus…
- L’absence de type petit mal qui dure quelques secondes (parfois on ne les remarque pas).
Elle apparait brutalement et s’arrête aussi brutalement.
- L’épilepsie partielle qui n’atteint qu’une partie du cortex (elle n’est pas généralisée). La
clinique de cette maladie épileptique dépend de la zone corticale touchée (crises motrices,
sensorielles, auditives, visuelles, comportementales).
- Il existe des formes rares d’épilepsie, comme le syndrome d’épilepsie myoclonique juvénile.

4
La complication majeure correspond à l’état de mal épileptique où il y a un risque d’arrêt
cardio-respiratoire. Ce sont des états de crises qui se succèdent et qui ne s’arrêtent pas. Là il
faut un traitement d’urgence : benzodiazépines, ventilation assistée, anti-épileptiques, contrôle
ECG…
Concernant la physiopathologie, on a une hyperexcitabilité neuronale intrinsèque qui est
due à des anomalies innées ou acquises (on peut devenir épileptique suite à un accident) des
propriétés et/ou de la structure de la membrane cellulaire touchant les canaux ioniques
voltages dépendants. On aura une augmentation du flux sodique et calcique, qui est à l’origine
des décharges électriques.
On a des phénomènes inter-neuronaux, qui correspondent à un défaut d’inhibition
synaptique GABA-ergique : le GABA est diminué. Il y a donc un défaut de l’action
inhibitrice du GABA, et du coup une augmentation de l’excitation synaptique.
On trouvera aussi une augmentation de glutamate, d’aspartate augmentation de
l’excitation synaptique.
Et il y a aussi des phénomènes intriqués variables selon le syndrome épileptique du
patient. Tout n’est pas forcément expliqué, il y a des formes que l’on n’arrive pas à stabiliser.
B. Mode d’action des médicaments antiépileptiques
On ne guérit pas de l’épilepsie. Les traitements que l’on a servent à réduire les crises.
Sur le schéma, on a les antiépileptiques les plus connus :
On peut observer en haut à droite, la naissance supposée d’une crise partielle au niveau d’un
foyer spécifique (= région du cerveau). Ces crises peuvent se limiter à des secousses
cloniques au niveau d’une extrémité du corps ou alors se propager et se généraliser avec des
crises généralisées.

5
On a plusieurs classes de médicaments anti épileptiques. Ils vont être utilisés pour contrôler
les crises. (Ce sont surtout les principales classes de médicaments et leur mode d’action
qu’elle nous demande de retenir, et non les noms de médicaments.)
Parmi ceux utilisés, il y a des médicaments qui :
- visent une augmentation du GABA (Celui ci étant diminué dans l’épilepsie).
Exemple : Benzodiazépines agissant sur les récepteurs benzodiazépines, Phénobarbital.
- cherchent une diminution des flux de Na+ (en haut à droite sur le schéma),
puisqu’on a une augmentation du flux sodique.
Exemple : Phénytoïne, Cabarmazépine, Valproate (= acide valproïque).
- exercent une action sur les canaux Ca2+ en inhibant le courant calcique
étant à l’origine des décharges électriques dans les neurones au niveau du
thalamus (en bas à droite sur le schéma).
Exemple : Ethosuximide, Valproate.
Les flux de Na+, Ca2+ et Cl- sont les principales cibles des antiépileptiques (le flux de Cl- étant
modifié grâce aux récepteurs benzodiazépines).
MODE D'ACTION DES MEDICAMENTS ANTIEPILEPTIQUES
Les récepteurs aux benzodiazépines peuvent fixer non seulement les benzodiazépines, mais
aussi le GABA et les barbituriques. Avec la fixation de l’un, le récepteur change de
conformation et laisse passer le Cl-. Ce récepteur n’est donc pas spécifique des
benzodiazépines.
En résumé, les antiépileptiques provoquent :
- Une diminution des phénomènes excitateurs par :
Blocage des canaux Na+ et Ca2+ (blocage de la dépolarisation neuronale)
Diminution de la libération des neurotransmetteurs excitateurs (glutamate)
- Un renforcement des phénomènes inhibiteurs par :
Augmentation du contenu cérébral en GABA (soit par augmentation de synthèse, soit par
diminution de dégradation)
Ouverture des canaux Cl- hyperpolarisation membranaire.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%