Détermination graphique de la vitesse volumique

Cours chimie TS 2
1
Détermination graphique et évolution de la vitesse
volumique d’une réaction, facteurs cinétiques
On étudie la réaction suivante :
(g) 2
aq
3
aq
(s) H 3Al 2H 6Al 2
. Le volume de la solution
est de 200,0 mL.
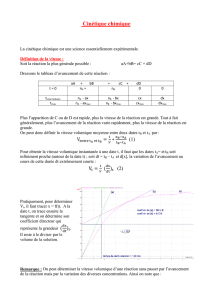
La courbe ci-dessous donne l’évolution de la quantité de dihydrogène formé au cours du
temps :
évolution de la quantité de matière
de dihydrogène au cours du temps
0
0,0005
0,001
0,0015
0,002
0,0025
0,003
0,0035
0,004
050 100 150 200 250 300
temps (en s)
quantité de
matière de
dihydrogène
(en mol)
Déterminer la vitesse volumique de la réaction à t = 0 s.
Par définition, la vitesse volumique à une date t’ est la valeur de la dérivée de la fonction x(t)
par rapport au temps, à la date t’ divisée par le volume de la solution :
'
1
)'(
t
dt
dx
V
tv
.
Or, le graphique représente l’évolution de la quantité de matière de dihydrogène formé au
cours du temps. On exprime donc la vitesse volumique de la réaction en fonction de cette
quantité de matière. Pour cela on construit un tableau d’avancement.

Cours chimie TS 2
2
Equation de la réaction
(g) 2
aq
3
aq
(s) H 3Al 2H 6Al 2
Etat
Avancement
Quantités de matières en mol
Etat initial
0
1
n
2
n
0
0
Etat en cours
de
transformation
x
xn 2
1
xn 6
2
x2
x3
Etat final
max
x
max1 2xn
max2 6xn
max
2x
max
3x
D’après le tableau d’avancement :
xn 3)H( 2
. Donc on remplace dans l’expression de la
vitesse volumique :
'
2)H(
31
)'(
t
dt
dn
V
tv
On utilise maintenant la courbe représentant l’évolution de la quantité de matière de
dihydrogène formé au cours du temps pour déterminer
'
2)H(
t
dt
dn
à la date t = 0. Pour cela
on trace la tangente à la courbe au point d’abscisse 0 :

Cours chimie TS 2
3
On détermine maintenant son coefficient directeur qui est égal à
0
2)H(
dt
dn
.
On utilise deux points : le point
)0;0(O
et le point
)1085,2;125( 3
A
. Le coefficient directeur
m est donné par :
OA
OA xx
yy
m
.
D’où
1-5
3
0
2mol.s 103,2
0125 01085,2
)H(
m
dt
dn
.
On peut donc en déduire la vitesse volumique à la date t = 0 :
1-1-55
3s.mol.L 108,3103,2
310200 1
)0(
v
.
Comment évolue la vitesse volumique de la réaction ? Comment interpréter
cette évolution ?
Au cours du temps, on constate que les tangentes deviennent horizontales, par conséquent leur
coefficient directeur diminue et tend vers 0. On peut donc en déduire que la vitesse volumique
de la réaction diminue et tend vers 0.
On interprète ce résultat par le fait que la concentration en réactif diminue au cours du temps.
La concentration en réactifs diminue (la concentration en réactif diminue).
Comment pourrait-on atteindre plus rapidement l’état final du système ?
Si on utilise de la poudre d’aluminium, on augmente la surface de contact entre les réactifs ce
qui a pour conséquence d’augmenter la vitesse de réaction.
La température étant un facteur cinétique, si on augmente la température, la vitesse de
réaction sera plus grande.
1
/
3
100%