Contôle génétique et épigénétique du développement du pancréas

Cécile Haumaitre
Contrôle génétique et épigénétique du
développement du pancréas chez la souris et
maladies humaines associées
CNRS UMR 7622 / INSERM ERL 969
Laboratoire de Biologie du développement
Université Pierre et Marie Curie, IFR83
9, quai St Bernard - 7ème étage
Paris

• 2001- 2005 : Thèse de Génétique du Développement
Université Paris VI
INSERM U423 / CNRS UMR 7622, Paris.
Equipe du Dr Silvia Cereghini
“ Organogenèse précoce chez la souris et maladies génétiques associées”
•2005 - : Post-doctorat (CDD INSERM depuis octobre 2005)
INSERM U845, Centre de Recherche “Croissance et Signalisation”
Faculté de Médecine Necker, Paris.
Equipe du Dr Raphaël Scharfmann
“ Développement normal et pathologique des organes endocrines”
Recrutement en CR2 (Chargé de Recherche) à l’INSERM en 2009
CNRS UMR 7622 / INSERM ERL 969 - Université Pierre et Marie Curie
Equipe du Dr Silvia Cereghini

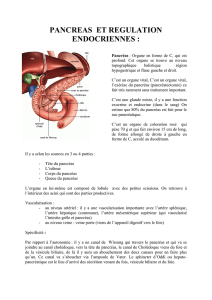
Le pancréas
Le pancréas mature est composé de 2 types de tissus :
- exocrine : cellules acinaires et canalaires enzymes digestives
- endocrine : îlots hormones régulant l’homéostasie glucidique
îlot de Langerhans
Cellules β
productrices d’insuline

Pourquoi s’intéresser au pancréas ?
- Comprendre comment un organe complexe se forme
(Recherche en Biologie du Développement)
- Contribuer au développement de stratégies de thérapie du diabète
(Recherche Médicale)
Le diabète : diminution de la masse fonctionnelle des cellules β
qui produisent l’insuline
- type 1 : destruction des cellules β
- type 2 : résistance à l’insuline
A l’heure actuelle, on sait soigner mais on ne sait pas guérir les patients diabétiques
Développement de nouvelles approches thérapeutiques
pour fournir une masse de cellules β fonctionnelles
- thérapie cellulaire
- approches régénératives
Pour cela, il faut comprendre comment les cellules pancréatiques,
les cellules endocrines et les cellules β sont formées au cours du développement
Et pouvoir reproduire cette différenciation (à partir de cellules souches embryonnaires ou adultes
ou d’autres types cellulaires (trans-différenciation))

Développement du pancréas et régulation génétique
acini
Exocrine canaux
Endocrine
α
PP
δ
β
Progéniteurs
Pdx1
Facteurs de
transcription
Arx
Pax4
Ngn3
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
1
/
22
100%