FCC12 mise en page - Chirurgie

SOMMAIRE
E. TIRET (Paris)
F. BRETAGNOL (Clichy)
A. BROUQUET (Boulogne)
F. BRETAGNOL (Clichy)
E. TIRET (Paris
G. MEURETTE (Nantes)
J. CAZEJUST (Paris)
Y. PARC (Paris)
J. LEFEVRE (Paris)

FACTEURS DE RISQUE DES DESUNIONS ANASTOMOTIQUES APRES
ANASTOMOSE COLO-RECTALE OU ANASTOMOSE COLO-ANALE
Antoine Brouquet

Références

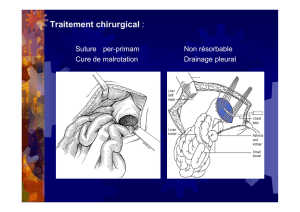
PREVENTION DES FISTULES ANASTOMOTIQUES
Frédéric Bretagnol

Références
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%