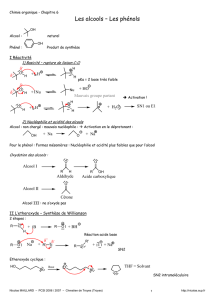
Alcools et éthers
Définitions et propriétés
Dipole permanent
Les alcools sont des composés qui dérivent formellement des hydrocarbures par
remplacement d'un atome d'hydrogène par une fonction hydroxyle OH.
formation / rupture de la liaison C/ O
polarité des alcool du aux différence
d’électronégtivité
solvant protique polaire

Classe
:
Selon
que
l'atome
de
carbone
portant
la
fonction
alcool
est
lié
à
1
,
2
,
3
atomes
Alcools et éthers
Définitions et propriétés
Classe
:
Selon
que
l'atome
de
carbone
portant
la
fonction
alcool
est
lié
à
1
,
2
,
3
atomes
de carbone, le dérivé est qualifié de primaire, secondaire, tertiaire.
H
OHC
H
ROHC
R
'
R
H
C
R
'
R
R"
OH
primaire secondaire tertiaire

Suffixe :
ol
Alcools et éthers
Nomenclature
Suffixe :
ol
Préfixe : hydroxy
OH
1
2
3
4
Butan-1-ol (ou n-butanol)
OH
Butan-2-ol
1
2
3
4OH
1
2
2-Méthylpropan-2-ol
(ou tert-butanol)
3
COOH
OH
2
Acide 2-hydroxypropanoïque
(acide lactique)

Liaisons hydrogène intermoléculaires
R
O
H
R
Alcools et éthers
Propriétés
R
O
O
R
HO
H
R
Conséquences : points d’ébullition élevés
Méthanol dans l’eau
H
3
CCH
3
H
3
CCH
2
OH
H
3
COCH
3
-
8
8
,
5
-24
+78,3
°
°
°
Conséquences : solubilité dans l’eau est
fonction de la longueur de la chaine carbonée
C
H
3
C
H
2
O
H
m
i
s
c
i
b
l
e
CH
3
(CH
2
)
2
0
OH
n
o
n
m
i
s
c
i
b
l
e
entièrement miscible
car les 2 peuvent généré des liaisons H et concourent à 1 eq
tridim qui est homogène
demisction les 2 entités ne sont plus miscible
en tt proportion
on forme ainsi des micelles la tête polaire n’est plus
assez lourde par rapport au reste de la molécule
pour entrainer le reste de la chaine carbonné
dans l’eau

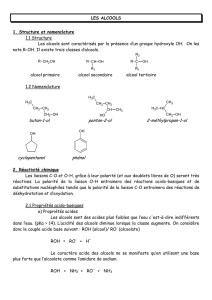
Les alcools sont des composés amphotères, ils peuvent se comporter à la fois comme des
bases et comme des acides:
H
Base
f
o
r
t
e
Acide
f
o
r
t
H
Alcools
Propriétés
RO
H
f
o
r
t
e
f
o
r
t
RO
H
H
RO
alcool
ion
alkoxyde ion
alkyloxonium
sont des amphotères
= peut etre acide ou bases
l’ion oxonium est l’acide du couple alcool/oxonium
les formes oxnm ont des acidités très fortes
Amphotère
primaire
tertiare
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
1
/
42
100%