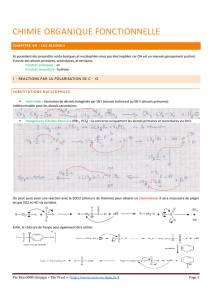
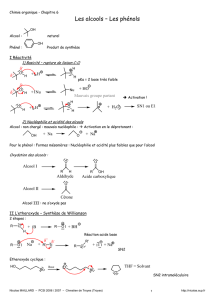
Synthèses de dérivés halogénés et d`alcènes

Université du Maine – Faculté des Sciences ⌫ Retour CHIM308B-semaine 0
Interconversion de groupes fonctionnels-Annexe-11
Préparation de dérivés halogénés et d'alcènes à partir d'alcools
1) Hydracides : HX
Il y a protonation du groupe hydroxyle.
R-OH + HX → RO+H2 + X- → R+ + H2O
R
+ + X- → R – X
La réactivité des hydracides évolue dans l'ordre : HI > HBr > HCl
La réactivité des alcools évolue dans l'ordre : allyl, benzyl > 3° > 2° > 1°
La réaction est généralement de type SN1 (sauf MeOH et alcools primaires) et elle peut être accompagnée de
réarrangements du carbocation (même sur primaires encombrés : néopentyl).
A noter que les phénols ne réagissent pas du tout.
2) Halogénures d'acides inorganiques : SOCl2 , PCl5 , POCl3 , PCl3
Cette réaction est souvent préférable à la précédente car elle est souvent SN2 ou SNI et ne donne pas de réarrangement.
Le principe est de remplacer le groupe OH mauvais groupe partant par un groupe meilleur groupe partant. La réaction de
l'alcool avec ces réactifs conduit à des esters inorganiques tels :
RO S Cl
O
RO P Br
Br RO P Cl4
et formation de HX. La réaction ayant lieu en présence d'une amine comme base, il se forme le sel de l'amine et les ions X –
donnent une attaque nucléophile sur l'ester inorganique. Avec les dérivés du phosphore, la réaction peut se répéter sur les
différents atomes d'halogènes. Avec SOCl2, la réaction peut suivre un autre mécanisme si il n'y a pas de base dans le milieu: il
y a une substitution interne SNi avec rétention de configuration
OS
O
Cl
R1
R2R3Cl
R1
R2R3
+ SO2
3) Déshydratation des alcools
CC
H
OH
CC
Al
2O3300°C
H2SO4 ou
+ H2
O
Plusieurs types de conditions opératoires peuvent intervenir. La réaction a lieu en général en milieu acide (OH mauvais
GP : H2O+-R) et le mécanisme est E1 donc possibilités de réarrangements. L'ordre de réactivité des alcools est :
3°) > 2°) > 1°).
C'est la réaction inverse de l'addition d'eau à un alcène : c'est un équilibre à déplacer.
Pour éviter la SN1 on opère avec des acides dont les anions sont peu nucléophiles tels HSO4- ou ArSO3
- (acides
sulfoniques)
1
/
1
100%