TP de biologie moléculaire

Biologie – TP B3-4-5-6 – Biologie moléculaire et cellulaire
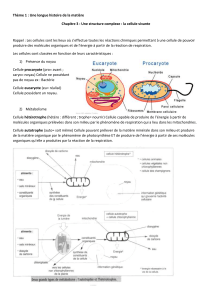
TP B3-4-5-6. Base de biologie cellulaire et moléculaire
Introduction
But du TP :
–asseoir les connaissances du lycée relatives à l'organisation de la cellule
–revoir et approfondir les techniques de microscopie
–découvrir quelques manipulations de biologie cellulaire
–découvrir la diversité des microorganismes
–aborder quelques manipulations classiques de biologie moléculaire
Ce TP sera découpé en quatre séances.
I. Etude de la cellule par les techniques de microscopie
Rappel : 1 mm = 1.10-3 m ; 1 μm = 1.10-6 m ; 1 nm = 1.10-9 m.
1. Observation de l'ultrastructure cellulaire au microscope optique
a) Principe
Le microscope optique (ou photonique) est un instrument permettant de fournir une image grossie d'un objet.
Fondamentalement, le microscope optique est un microscope à transmission : la lumière traverse l'objet à
observer. Pour cette raison, l'objet doit être extrêmement fin.
Document 1: Structure d'un microscope optique
classique. Légende : 1. oculaires ; classiquement,
grossissement x10 ou x16 ; 2. porte-oculaire
réglable ; 3. porte-objectifs ; 4. objectifs ;
classiquement, grossissements x4, x10, x40, x60,
x100 ; 5. potence fixe6. platine réglable en
hauteur7. porte-objets réglable latéralement et en
profondeur8. condenseur9. diaphragme10. source
lumineuse ; en général, diaphragme et réglage de
l'intensité lumineuse11. socle12. vis
macrométrique de mise au point13. vis
micrométrique de mise au point
Principe de l'observation microscopique. Avant d'observer, un examen à l'œil nul de la position de la lame
permet de s'assurer qu'elle est bien sous l'objectif. L'observation commence toujours avec l'objectif de plus
faible grossissement. Une fois la mise au point effectuée (la vis macrométrique, puis micrométrique, permet
en montant ou descendant l'objet, de le placer sur le point focal objet), le zoom se fait en passant à un objectif
1 BCPST1 – Lycée Châtelet – Douai – Joseph NICOLAS

Biologie – TP B3-4-5-6 – Biologie moléculaire et cellulaire
plus puissant, sans changer la mise au point (si ce n'est pour des réajustements mineurs). En effet, le point
focal objet du système optique constitué par le microscope est le même pour tous les objectifs : la position de
netteté est unique.
Pouvoir séparateur du microscope. On appelle limite de séparation la distance minimale en dessous de
laquelle deux points ne peuvent plus être distingués. La limite de séparation d obéit à la loi suivante :
d=0,6 λ
(nsin α)
où λ est la longueur d'onde de la lumière utilisée, n l'indice
de réfraction du milieu et α l'angle entre l'axe optique et le
rayon extrême entrant dans l'objectif (voir image ci-
contre). La valeur de sin α est donnée sur l'objectif (à côté
du grossissement).
Le pouvoir séparateur, ou résolution, est l'inverse de la
limite de séparation.
On peut donc maximiser le pouvoir séparateur :
–en minimisant la longueur d'onde, c'est à dire en
utilisant une longueur d'onde plus proche du bleu (400 nm) que du rouge (800 nm). En pratique, la
lumière blanche étant polychromatique (mélange de plusieurs couleurs), on ne réalise cette
optimisation qu'avec des microscopes confocaux dont la source lumineuse est un laser (donc
monochromatique).
–en maximisant l'indice de réfraction du milieu. En pratique, l'indice de réfraction de l'air est de 1.
Pour les objectifs de plus fort grossissement, on peut utiliser une huile à immersion, dont l'indice de
réfraction est de 1,5. Il permet donc d'augmenter significativement la résolution.
–en maximisant l'angle α. En pratique, cela revient à avoir un objectif extrêmement proche de l'objet ;
c'est le cas pour l'objectif x100 en particulier, qui est à une distance de la lamelle largement
inférieure au millimètre.
Pour information, la limite de séparation de l'oeil humain est d'environ 200 μm, soit 1/5 de mm.
b) L'ultrastructure cellulaire au microscope optique
Les cellules constituent l'unité structurale de base de tout être vivant. Elle ont en général une taille moyenne
comprise entre 1 μm et 100 μm, donc en dessous de la limite de séparation de l'œil humain. L'étude des
structures cellulaires passe donc nécessairement par la microscopie optique.
Manipulations : vous allez réaliser différentes préparation microscopiques.
NB : une préparation microscopique doit être la plus fine possible (idéalement l'épaisseur d'une cellule).
Différentes techniques permettent, selon les tissus, à arriver à une telle épaisseur.
i. Feuilles d'élodée du Canada
L'élodée du Canada (Elodea canadensis) est une plante marine d'origine nord-américaine, aujourd'hui
invasive en Europe. La finesse de ses feuilles est telle qu'aucune préparation n'est nécessaire pour
l'observation. Un éclairage important permet de mettre en évidence la cyclose, c'est-à-dire le déplacement
des chloroplastes dans le cytoplasme. Vous réaliserez un dessin, que vous utiliserez pour déterminer la taille
des structures cellulaires reconnaissables (notamment les chloroplastes).
ii. Parenchyme de réserve de tubercule pomme-de-terre
2 BCPST1 – Lycée Châtelet – Douai – Joseph NICOLAS

Biologie – TP B3-4-5-6 – Biologie moléculaire et cellulaire
Le tubercule de pomme-de-terre (Solanum tuberosum) contient un polyoside, l'amidon, qui constitue la
majeure partie de la réserve glucidique de cette plante. Il est contenu dans des organites appelés
amyloplastes. Il peut être révélé par la coloration au lugol, ou eau iodée. La coupe doit être particulièrement
fine (utilisation d'un scalpel très aiguisé ou d'une lame de rasoir). Vous réaliserez un dessin, que vous
utiliserez pour déterminer la taille des structures cellulaires reconnaissables.
Pour information : le lugol
L'eau iodée, ou lugol, est une solution aqueuse de diiode (I2) et
d'iodure de potassium (KI). Le diiode, normalement très peu
soluble dans l'eau, forme un complexe avec l'ion iodure I-, qui forme
un ion triiodure I3-, très soluble. Le lugol est utilisé principalement
pour mettre en évidence divers polyosides, comme l'amidon
(coloration bleu nuit) et le glycogène (coloration brun acajou). La
réaction, totalement réversible, est une complexation de l'ion I3- avec
les radicaux -OH de l'hélice formée par le polyoside (image ci-jointe :
l'ion triiodure au centre, les glucoses de la chaîne d'amidon autour).
Elle s'accompagne d'une modification de la structure électronique de
l'ion triiodure, ce qui provoque une interaction différente avec la
lumière, et donc une couleur bleue nuit, alors que de la couleur de
l'ion seul est orange.
iii. Observation et plasmolyse d'épiderme d'oignon rouge
L'oignon rouge (Allium cepa) doit sa couleur à des anthocyanes, qui sont séquestrées dans un organite
particulier : la vacuole. On propose de mettre en évidence l'existence d'une vacuole colorée par plasmolyse.
Il s'agit de placer les cellules dans un environnement hypertonique (c'est-à-dire très riche en solutés), en
injectant de l'eau salée entre la lame et la lamelle, et en absorbant le liquide de l'autre côté, tout en observant.
Vous mettrez également en évidence, de cette façon, la présence de jonction cellulaires, appelées les
plasmodesmes.
Exercice : comprendre la plasmolyse.
L e potentiel hydrique (noté Ψ, /psi/) est une grandeur thermodynamique qui a la dimension d'une
pression ; son unité dans le SI est donc le Pascal (Pa). Elle mesure la tendance de l'eau à rester dans un
compartiment donné : l'eau se déplace des compartiments à plus fort Ψ vers les compartiments à plus faible
Ψ. Le potentiel hydrique dépend de plusieurs paramètres :
–ΨP : la pression qui s'exerce sur le compartiment depuis l'extérieur, via, notamment une membrane ;
ΨP = P – Patm (P la pression et Patm la pression atmosphérique)
–Ψo : la pression osmotique, créant un appel d'eau d'autant plus important que la solution est
concentrée en ions ; Ψo = – RT ΣC (R la constante des gaz parfaits, T la température, ΣC la somme
des concentrations molaires dans la solution)
–Ψg : la pression hydrostatique exercée par une colonne d'eau ; Ψg = ρgh (ρ la masse volumique de
l'eau, g l'accélération de la pesanteur, h la hauteur d'eau).
–Ψm : l'effet matriciel, très difficilement quantifiable, qui prend notamment en compte l'ensemble des
phénomènes de tension superficielle qui font que, notamment, une éponge peut absorber
spontanément de l'eau.
D'où :
On négligera le cytosol, et on considèrera la cellule réduite à sa seule vacuole. On donne la concentration en
3 BCPST1 – Lycée Châtelet – Douai – Joseph NICOLAS
Ψ = Ψp + Ψo + Ψg + Ψm = P – Patm – RT ΣC + ρgh + Ψm

Biologie – TP B3-4-5-6 – Biologie moléculaire et cellulaire
glucose (le composant majoritaire) dans la vacuole : 10 g.L-1.
1. Après avoir déterminé l'expression du potentiel hydrique dans la vacuole et dans le compartiment
extérieur, calculez la pression osmotique s'exerçant sur les parois de la cellule lorsque l'épiderme
d'oignon rouge est dans l'eau distillée, en explicitant votre raisonnement.
2. Justifiez, en utilisant la formule du potentiel hydrique, que la cellule subisse une plasmolyse
lorsqu'on la place dans un milieu hypertonique (concentration : 200 g.L-1 ; M(Na) = 23 g.mol-1 ;
M(Cl) = 35,5 g.mol-1).
2. Observation de l'ultrastructure cellulaire au microscope électronique à transmission
a) Principe
Contrairement au microscope optique, le microscope électronique n'exploite pas la lumière. L'image qu'il
donne est donc forcément une image reconstituée. Il utilise la capacité de la matière à interagir avec un
faisceau d'électrons à haute vitesse généré par des électrodes. Les électrons interagissant avec toutes les
molécules rencontrées, il est indispensable de travailler dans le vide. La microscopie électronique est donc
nécessairement pratiquée sur des échantillons secs, et donc morts.
L'absence de lumière fait que les couleurs parfois visibles sur les images sont des couleurs interprétatives
ajoutées secondairement par un informaticien sur l'image brute.
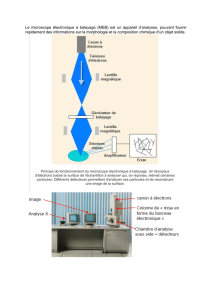
Il existe deux types de microscopes électroniques : le ME à transmission et le ME à balayage. Dans le ME à
transmission (MET), l'échantillon est une coupe fine. Les électrons le traversent, et certaines zones, dites
denses aux électrons, arrêtent ou réfléchissent plus les électrons que d'autres zones. Dans le ME à balayage
(MEB), l'échantillon est en relief, et est recouvert d'une fine couche de métal, sur laquelle les électrons se
réfléchissent. Le temps d'arrivée au capteur permet de restituer une image en trois dimensions de la surface
de l'objet, comme le ferait un sonar. L'utilisation du MEB sera vu dans la section suivante.
Les deux techniques donnent des informations très différentes, et
ne sont habituellement pas utilisées sur les même types d'objets.
Résolution des microscopes électroniques. Comme pour le
microscope optique, la résolution du microscope électronique
repose sur la capacité à discriminer deux points proches. Elle est
dépendante de la longueur d'onde des électrons. En effet, la
théorie quantique permet d'associer un caractère ondulatoire à
toute particule. La longueur d'onde d'un électron d'un faisceau
étant beaucoup plus faible que la longueur d'onde d'un photon, la
résolution du microscope électronique peut être presque 5 000
fois meilleure que celle du microscope optique (limite de
séparation maximale de 0,1 nm), et permet d'accéder à une
diversité de structures inaccessibles au microscope optique.
b) Ultrastructure cellulaire au MET
La majeure partie des organites sont des compartiments isolés du
reste de la cellule par une membrane. Or les membranes sont
des structures lipidiques très pauvres en eau. Après dessiccation
des échantillons, elles restent très denses aux électrons,
contrairement aux autres zones. C'est donc principalement par
l'identification du réseau endomembranaire que s'appréhende
l'ultrastructure cellulaire au microscope électronique à
transmission.
4 BCPST1 – Lycée Châtelet – Douai – Joseph NICOLAS
Document 2: Principe du microscope
électronique à transmission

Biologie – TP B3-4-5-6 – Biologie moléculaire et cellulaire
Travail demandé :
–à partir des images présentées, vous calculerez pour chacune d'entre elle la taille approximative des
structures représentées
–vous les utiliserez pour réaliser un schéma de l'organisation d'une cellule végétale type. Ce schéma
sera convenablement légendé, et veillera à respecter les échelles des différents organites.
Document 3: Membrane d'un
ovocyte de souris. Barre : 30 nm
Document 4: Les membranes de deux cellules adjacentes.
x500 000
Document 5. Une mitochondrie d'un hépatocyte humain. me : membrane externe ; mi : membrane interne ;
c : crête ; m : matrice. x 150 000
Document 6. L'appareil de Golgi ; barre :
300 nm
Document 7. Un
ARNm (mRNA) en
cours de traduction
dans le cytosol. Les
épaississements en
collier de perles sont
des ribosomes.
Polypeptide chain :
protéine en
formation. x
1 000 000
5 BCPST1 – Lycée Châtelet – Douai – Joseph NICOLAS
m
c
me
mi
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
1
/
22
100%