Cahier d`Exercices de BIOCHIMIE 4. Métabolisme

http://www.chusa.upmc.fr/disc/bio_ce ll
P C E M 1
Cahier d’Exercices
de BIOCHIMIE
2008-2009
EDITE PAR LE DEPARTEMENT DE BIOLOGIE
4. Métabolisme
Energétique

Cahier d'Exercices en Biochimie / PCEM1 Métabolisme énergétique / 2
Faculté de Médecine Pierre & Marie Curie
CAHIER D'EXERCICES POUR PCEM1
BIOCHIMIE
I V . M E T A B O L I S M E E N E R G E T I Q U E
S O M M A I R E
Pag e
1. Bioénergétique ............................ 3
2. Chaîne respiratoire mitocho ndriale ....... 4
3. Glycolyse.................................... 5
4. Cycle de Krebs ......….................... 7
5. Métabolisme énergétique ................. 8
6. QCM.…...................................... 12
7. Annales du concours .…................... 14
Image de couverture:
Schéma fonctionnel de l'ATP synthase (Prix Nobel de chimie 1997: schéma tiré de
http://www.nobel.se/chemistry/laureates/1997/illpres )

Cahier d'Exercices en Biochimie / PCEM1 Métabolisme énergétique / 3
Faculté de Médecine Pierre & Marie Curie
1. BIOENERGETIQUE
1.1 La variation d'énergie libre ( ΔG ) dépend-elle :
a. des caractéristiques (nature, concentration) des réactifs ?
b. des caractéristiques (pH, température) du milieu biologique ?
c. des transformations intermédiaires de la catalyse enzymatique ?
1.2 Valeur probable de la variation d'énergie libre ( ΔG ) pour une réaction
a. exergonique
b. évoluant rapidement
c. à l’équilibre
d. réversible dans les conditions physiologiques
1.3 Indiquer en 3 lignes quelle(s) différence(s) il y a entre la variation de l'énergie libre
(ΔG) et l’énergie d'activation d'une réaction.
1.4 Qu'appelle-t-on "couplage énergétique" entre 2 réactions biochimiques ?
Donner 1 exemple de mécanisme de couplage.
1.5 Soient les énergies libres standards d'hydrolyse ΔGo' des molécules suivantes :
ATP - 30,5 kJ/mole
Glucose-6P - 13,8 kJ/mole
a. Quelle est la variation d'énergie libre standard ∆G°' de la réaction :
ATP + Glucose ADP + Glucose-6P
b. Dans quel sens va se produire cette réaction si tous les composants sont présents
initialement à la même concentration ?
c. De quelle manière évoluerait le déroulement de cette réaction dans des conditions
plus physiologiques caractérisées par les concentrations suivantes : [ATP] 2,25 mM ;
[ADP] 0,25 mM ; [Glucose] 3 mM ; [Glucose-6P] 1,5mM.
On donne : T = température absolue = 273°K + valeur °C ; R = 8,31 Joules/mole ;
Ln 5,55.10-2 = - 2,89 ; Ln 18 = + 2,89
1.6 Soient les réactions :
1. ATP + Glycérol Glycérol-3P + ADP
2. Phospho-énolpyruvate + ADP Pyruvate + ATP
3. Glucose-6P + ADP Glucose + ATP
Soient les énergies libres d'hydrolyse ∆G°' des molécules suivantes :
ATP - 30,5 kJ/mole
Glycérol-P - 9,2 kJ/mole
PEP - 61,9 kJ/mole
Glucose-6P - 13,8 kJ/mole
a. Calculer les ∆G°'.
b. Dans quel sens vont se produire les réactions à 25°C si tous les composants sont
présents initialement à la même concentration ?

Cahier d'Exercices en Biochimie / PCEM1 Métabolisme énergétique / 4
Faculté de Médecine Pierre & Marie Curie
1.7 Pour la réaction catalysée par la Triose-P-isomérase : PDHA PGD
on a K'eq = [PGD]/[PDHA] = 0.0475 à 25°C et pH 7
a. Calculer la variation d'énergie libre standard ( ∆G°' ). La réaction est-elle possible si
[PDHA] = [PGD] ?
b. Calculer la variation de l'énergie libre ( ∆G ) lorsque
[PDHA] = 2x10-4 M et [PGD] = 3x10-6 M
(valeurs usuelles pour une cellule utilisant la glycolyse comme voie énergétique).
La réaction est-elle possible ?
(PDHA : phosphodihydroxyacétone ; PGA : phosphoglycéraldéhyde)
1.8 Le transfert d'électrons dans la chaîne respiratoire mitochondriale peut-être
représentée par la réaction nette :
NADH, H+ + 1/2 O2 H2O + NAD+
a. Entre les 2 couples conjugués d'oxydo-réduction, lequel à la tendance la plus grande
à perdre ses électrons ? Pourquoi ?
b. Calculer la valeur de la variation du potentiel standard d'oxydo-réduction ∆Eo' pour
cette réaction de transfert d'électrons mitochondrial.
c. Calculer la variation d'énergie libre standard ∆Go' associée à cette réaction.
d. Combien de molécules d'ATP pourraient en théorie être formées par molécule de
NADH oxydée au cours de cette réaction, si l'on prend l'énergie libre standard de synthèse
d'ATP égale à 30,5 kJ/mole ?
e. Combien de molécules d'ATP sont synthétisées dans les cellules en temps ordinaire ?
Quel est donc le rendement de conservation d'énergie au cours de ces réactions ?
On donne : T = température absolue = 273°K + valeur °C ; R = 8,31 Joules/mole ;
E°’ du couple NAD +/NADH+H+= - 0,32 volts ; E°’ du couple 1/2 O2 / H2O= + 0,81 volts
F : 96500 J/volt/mole.
2. CHAINE RESPIRATOIRE MITOCHONDRIALE
2.1 Chaîne respiratoire.
a. Quelle est sa localisation et sa fonction ?
b. D'où vient son énergie de fonctionnement ?
c. Que produit-elle ?
d. Quel est le rôle de l‘ oxygène dans la respiration mitochondriale ?
e. Quel est son rendement de conservation d'énergie ?
f. En présence de dinitrophénol, la chaîne respiratoire n'est pas bloquée mais elle perd
sa fonction initiale.
g. Pourquoi ?
2.2 Décrire les différents transporteurs de la chaîne respiratoire :
a. Lesquels transportent 1 électron, 2 électrons ?
b. Lesquels sont libres ?
c. Lesquels sont associés dans des complexes membranaires ?
d. Dans quel ordre interragissent-ils ? Pourquoi ?
2.3 a. Citer les différents substrats de la chaîne respiratoire.
b. A quel complexe de la chaîne est couplée l’oxydation de ces substrats ?
c. Quel sera l’effet sur la consommation d’oxygène par les mitochondries de l’addition
de :

Cahier d'Exercices en Biochimie / PCEM1 Métabolisme énergétique / 5
Faculté de Médecine Pierre & Marie Curie
• Antimycine A
• Oligomycine
• Dinitrophénol
• Oligomycine + dinitrophénol
3. GLYCOLYSE
3.1 Au cours de la glycolyse, le glucose (C6) est transformé en pyruvate (C3).
a. Quelle enzyme est responsable de la scission de la molécule à 6 carbones en
molécules à 3 carbones ?
b. Quelles sont les caractéristiques de ces molécules à 3 carbones ?
c. Cette préparation pour l'hydrolyse a nécessité quel(s) type(s) de modification du
glucose ?
d. Une seule de ces molécules à 3C poursuit directement sa transformation dans la voie
métabolique pour être convertie en pyruvate.
• Laquelle ?
• Quel est le devenir de la deuxième ?
e. Quel est le bilan énergétique de cette première phase de la glycolyse, dite phase
préparatoire ?
3.2 a. Quelles sont les étapes irréversibles de la glycolyse ?
b. Pourquoi sont-elles irréversibles ?
c. Quelles sont les caractéristiques d’une enzyme clef intervenant dans la régulation
d’une voie métabolique ?
d. Quelle est l’enzyme clef de la régulation de la glycolyse ?
3.3 Quelles sont les transformations métaboliques possibles du pyruvate produit lors de
la glycolyse en conditions aérobie et anaérobie ?
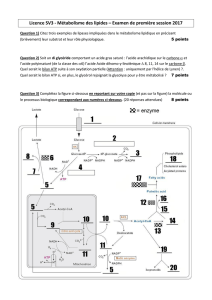
3.4 Soient les réactions suivantes :
Sachant que les enzymes catalysant les réactions a et b ne sont pas identiques,
• Ecrire la formule de X
• Donner les noms des coenzymes intervenant dans les réactions a et b.
• Donnez le nom et la localisation cellulaire des enzymes catalysant les
réactions a et b. Que permettent ces réactions dans le métabolisme énergétique ?
3.5 Les globules rouges métabolisent le glucose à vitesse élevée en formant du lactate.
Pourquoi la production de lactate est-elle nécessaire pour que l’utilisation du glucose
puisse se poursuivre ?
Pourquoi pour mesurer le glucose sanguin (glycémie) ajoute t-on du fluorure de sodium
dans les tubes de prélèvement ?.
b
X
a
P
C=O
CH2OH
CH2O
P
C=O
CH2OH
CH2O
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%