L A

ACTUALITÉ
7
La Lettre d’Oto-rhino-laryngologie et de chirurgie cervico-faciale - no254 - juin 2000
L
e Laboratoire Glaxo Wellcome a organisé, le 1er avril
dernier à Paris, une journée d’actualités en ORL.
Nous vous rapportons ici un résumé des communi-
cations présentées.
LES PERFORATIONS APRÈS TYMPANOPLASTIE
(C. Dubreuil, Lyon)
Il persiste ou réapparaît une perforation tympanique après 2 à
10 % des myringoplasties. Ces perforations sont immédiates ou
précoces (dans les six premières semaines) dans 40 à 60 % des
cas, mais elles peuvent aussi survenir secondairement, plusieurs
mois ou années après l’intervention. Les reperforations anté-
rieures sont les plus fréquentes.
Les facteurs exposant à un risque accru de reperforation sont des
facteurs propres au patient (âge, facteurs régionaux), certaines
caractéristiques de la perforation et la technique chirurgicale. Ils
doivent être systématiquement évalués, particulièrement chez
l’enfant, car ils peuvent conduire à retarder ou contre-indiquer la
tympanoplastie.
Il n’y a pas de différence à court terme sur les résultats anato-
miques en fonction de l’âge, mais les risques de reperforation à
moyen et long terme sont majorés chez l’enfant du fait de la
reprise évolutive plus fréquente de la maladie causale. Il faut donc
savoir attendre, au moindre doute. L’âge charnière semble se
situer aux alentours de dix ans. Les facteurs régionaux altérant
la fonction tubaire doivent être recherchés et traités : l’hypertro-
phie adénoïdienne et amygdalienne, les amygdalites, les rhino-
sinusites chroniques infectieuses ou allergiques, les divisions
vélopalatines. De la même façon, l’examen de l’oreille contro-
latérale (perforation, poche de rétraction, otite séromuqueuse) est
un très bon élément d’orientation.
Une oreille humide non infectée ou une muqueuse légèrement
inflammatoire ne contre-indiquent pas la tympanoplastie. Le délai
d’assèchement de l’oreille, les interventions antérieures ne sont
pas significativement associés à un plus grand risque de reper-
foration. Les perforations par brûlure sont graves, et il faut
attendre 12 à 18 mois avant de les opérer. Le risque de reperfo-
ration est majeur dans les perforations antérieures, avec un mau-
vais contrôle peropératoire ne permettant pas la mise en place
correcte du greffon. Pour ce qui est de la taille de la perforation,
plus elle est importante, plus le risque de reperforation est élevé.
Il n’y a pas de différence significative entre le fascia et le péri-
chondre, mais le cartilage donne de meilleurs résultats (99 % de
fermeture stable du tympan). Il n’y a pas non plus de différence
significative dans la position du greffon en extra- ou sous-fibreux,
mais un risque augmenté de comblement de l’angle antérieur et
de cholestéatome en extrafibreux. Une antrotomie ou une mas-
toïdectomie dans une otite chronique simple n’améliore pas la
prise du greffon, mais risque d’altérer la conduction osseuse.
L’antibiothérapie de couverture est inutile, et seule une antibio-
prophylaxie est indiquée. Enfin, le risque de reperforation est
significativement diminué lorsque le chirurgien est entraîné
(au-delà de 20 interventions).
Les causes des perforations immédiates et précoces sont domi-
nées par les infections per- et postopératoires responsables d’une
nécrose du greffon. Les autres causes sont en relation avec la qua-
lité technique du geste opératoire et plus particulièrement le posi-
tionnement du greffon en avant, la prise d’un greffon trop petit
avec insuffisance de recouvrement par l’épiderme du conduit. À
noter les perforations par hyperpression, soit peropératoires (pro-
toxyde d’azote), soit postopératoires (mouchage, éternuement).
Les causes des perforations secondaires ne sont pas en rapport
avec la qualité du geste technique effectué. Elles correspondent
à une reprise évolutive de la maladie otitique (dysfonctionnement
tubaire, infection des voies aériennes supérieures). Elles peuvent
être associées à une poche de rétraction ou à une tympanosclé-
rose. Le délai après lequel on peut considérer un résultat comme
stable est de cinq ans.
Les principes chirurgicaux à respecter pour améliorer ces résul-
tats sont nombreux. Le premier est de ne pas utiliser de procédé
de myringoplastie “simplifiée”, d’avoir une bonne technique de
base, de savoir s’adapter aux difficultés inhabituelles et ne pas
adapter le patient à sa technique. L’asepsie de l’oreille opérée
doit être parfaite, donc réalisée avec patience. Le saignement per-
opératoire doit être réduit au maximum. Il faut respecter un inter-
valle de dix minutes entre l’injection de lidocaïne adrénalinée et
l’incision, et mettre le patient en proclive. La voie d’abord doit
être adaptée à la perforation et à la forme du conduit. Les inci-
sions du conduit auditif externe sont le plus économes possible,
le lambeau tympano-méatal doit être respecté avec soin. Le point
clé est d’exposer tout le tympan afin de positionner correctement
le greffon, particulièrement au niveau de l’angle antérieur (alé-
sage du conduit en cas de perforation antérieure ou de petit
conduit). Le bourrelet bordant la perforation est réséqué pour per-
3eJournée d’Actualités en ORL
●
P. Sagnet*, M. François*
* Service ORL, hôpital Robert-Debré, 48, boulevard Sérurier, 75019 Paris.

ACTUALITÉ
8
La Lettre d’Oto-rhino-laryngologie et de chirurgie cervico-faciale - no254 - juin 2000
mettre une meilleure réépidermisation. L’annulus et le sinus tym-
pano-méatal sont conservés. En l’absence d’annulus, il faut uti-
liser le toit du protympanum. La dessiccation du greffon (fascia
ou périchondre) est un point important. Le greffon doit être assez
grand, et être en contact avec le manche du marteau et l’annu-
lus ; un deuxième greffon glissé sous le manche du marteau
permet d’éviter une latéralisation. Il ne faut pas hésiter à uti-
liser un matériau de soutien du greffon comme le Gelita®ou le
Curaspon®. Enfin, le pansement est fondamental et il ne faut pas
le négliger. En cas de reprise chirurgicale, un délai de six mois
doit être respecté, et l’utilisation d’un cartilage aminci et de péri-
chondre est le garant de la réussite.
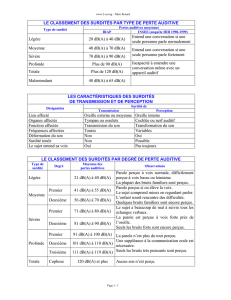
PLACE DE LA GÉNÉTIQUE DANS LES SURDITÉS DE L’ENFANT
(F. Denoyelle, Paris)
Les surdités neurosensorielles de l’enfant touchent en moyenne
2enfants sur 1 000. Avant les avancées importantes faites
dans le domaine des surdités génétiques non syndromiques, on
évaluait la répartition des surdités de l’enfant à 27-43 % de
causes extrinsèques, 30,5-45,5 % de causes génétiques et
30-39 % de causes inconnues (1). On sait maintenant que la
majorité des causes qui étaient alors inconnues sont en fait d’ori-
gine génétique. Ces surdités sont des maladies monogéniques
avec une importante hétérogénéité génétique. On peut donc
avoir un même tableau clinique pour des surdités dues à des
gènes différents. Il peut s’agir de surdités génétiques syndro-
miques (un tiers des cas) s’inscrivant dans un cadre de poly-
malformations, ou de surdités génétiques non syndromiques
(deux tiers des cas) isolées.
On dénombre plus de 400 syndromes comportant une surdité, et
plus de 100 gènes sont identifiés. En pratique, il n’y a pas de dia-
gnostic moléculaire de routine disponible, car c’est l’examen cli-
nique du généticien qui fait le diagnostic. Le livre de référence
pour identifier ces syndromes est Hereditary hearing loss and its
syndromes, de Gorlin RJ (Oxford University Press). Les grands
syndromes à connaître sont résumés dans le tableau I.
C’est en 1997-1998 que des avancées significatives dans le
domaine des surdités non syndromiques ont été enregistrées.
En effet, il existait auparavant un retard important pour la loca-
lisation et l’identification des gènes impliqués. Les trois quarts
des gènes se transmettent sur un mode autosomique récessif. Il
semblerait qu’une centaine de gènes soient à l’origine de ces
surdités : une soixantaine ont été localisés sur les chromosomes
humains (nomenclature des loci : DFNA1 à 19, DFNB1 à 25,
DFN1 à 6) et, en avril 2000, 16 gènes différents ont été identi-
fiés, sachant qu’en moyenne un gène nouveau est identifié tous
les 15 jours. Parmi ces mutations, DFNB1, qui touche la
connexine 26 (CX26), est largement prédominante puisqu’elle
représente 50 % des surdités autosomiques récessives non syn-
dromiques de l’enfant, la mutation 30 delG étant retrouvée dans
70 % des cas (1). Pour avoir un ordre d’idée, la fréquence des
porteurs hétérozygotes de 30 delG dans la population générale
est de 2,5 à 4 %, ce qui en fait la mutation pathogène humaine
la plus fréquente avec DeltaF508 du gène CFTR, responsable
de la mucoviscidose. Le phénotype de la surdité congénitale
liée à DFNB1 est une surdité à début prélingual, de degré
variable d’un patient à l’autre (un enfant peut être sourd pro-
fond et son frère sourd moyen), bilatérale et symétrique, n’évo-
luant pas, avec une courbe audiométrique plate ou descendante,
mais jamais en U ni ascendante, avec des épreuves caloriques
et une tomodensitométrie des oreilles internes normales.
Le bilan étiologique d’une surdité de perception de l’enfant est
résumé dans le tableau II. Mis à part le bilan ophtalmologique,
il ne doit pas être réalisé trop tôt, mais vers l’âge de quatre ans.
En effet, faire ce bilan avant sera difficile en ce qui concerne
la tomodensitométrie. Ce délai permet par ailleurs aux parents
d’assimiler la surdité de leur enfant et de mettre en place toutes
les structures nécessaires à sa prise en charge. Le bilan ophtal-
mologique est réalisé le premier, et répété tous les deux ans. Il
cherche à éliminer une rétinite pigmentaire dans le cadre d’un
syndrome d’Usher. S’il est positif, le risque de cécité associée
à la surdité fera poser plus précocement l’indication d’implant
cochléaire. Devant la découverte d’un syndrome de Pendred,
l’enfant est vacciné contre Streptococcus pneumoniae et Hae-
mophilus influenzae en raison de la malformation d’oreille
interne (malformation de Mondini quasi constante) et du risque
de méningite. Enfin, il ne faut jamais poser le diagnostic d’oto-
spongiose juvénile sans demander un bilan tomodensitomé-
trique : s’il s’agit en fait d’un syndrome de surdité mixte liée à
Tableau I. Surdités génétiques syndromiques (1).
Autosomiques dominantes
Autosomiques récessives
Récessives liées à l’X
Dominantes liées à l’X
Waardenburg
Branchio-oto-rénal
Usher
Pendred
1 % des surdités congénitales. Surdité mixte avec geyser-labyrinthe. Loci DFN3.
1% des surdités congénitales. Alport : glomérulopathie hématurique évoluant vers l’insuffisance rénale, surdité progressive.
2 à 5 % des surdités congénitales. Anomalies de pigmentation : peau, iris, rétine, cheveux. Surdité perceptive
de degré variable. Type 1 : dystopie canthale (absente dans le type 2). Hétérogénéité génétique ++.
2 % des surdités congénitales. Anomalies branchiales.
Surdité perceptive, transmissionnelle ou mixte. Malformation rénale.
Jusqu’à 5 % des surdités congénitales. Surdité profonde prélinguale (type 1) ou variable (types 2/3).
Atteinte vestibulaire (types 1 et 3). Rétinite pigmentaire précoce (types 1 et 3) ou retardée (type 2).
Jusqu’à 5 % des surdités congénitales. Surdité variable avec Mondini. Goitre hypo- ou euthyroïdien.

9
La Lettre d’Oto-rhino-laryngologie et de chirurgie cervico-faciale - no254 - juin 2000
partiments neurologiques en communication constante : le “cer-
veau auditif” et le compartiment de l’émotion. Pour cet auteur,
l’intensité de l’acouphène est directement liée à la densité de la
circulation neuronale entre ces deux compartiments. Le médecin
doit aider le patient à faire fonctionner son cerveau différemment
pour réduire cette circulation neuronale. Il doit non pas l’aider à
faire disparaître le symptôme, mais l’y habituer : “Je l’entends,
mais il ne me dérange plus”.
C’est la base de la thérapie acoustique d’habituation, qui uti-
lise des générateurs de bruit pour apprendre au cerveau à chan-
ger de référence. Si l’intensité relative de l’acouphène est de
10 dB et que le patient est dans le silence (0 dB), pour le cer-
veau, l’acouphène émerge de 10 dB par rapport à l’environne-
ment et le patient entend l’acouphène à son intensité maximale.
Avec un générateur qui masque complètement l’acouphène, le
cerveau ne retrouve pas d’écart entre l’environnement et l’acou-
phène : le patient n’entend plus l’acouphène, et il n’est à ce
moment-là pas possible qu’il s’y habitue. Si l’intensité du géné-
rateur est de 5 dB, pour le cerveau, l’acouphène émerge de 5 dB :
l’acouphène est toujours perçu, mais le contraste est atténué, le
cerveau prend une nouvelle référence de l’intensité de l’acou-
phène, la circulation neuronale entre les compartiments de
l’audition et de l’émotion se réduit. On voit donc qu’il ne faut
pas laisser le patient dans le silence et qu’il ne faut pas non plus
masquer complètement ses acouphènes, pour parvenir à un phé-
nomène d’habituation. Si ces règles sont bien respectées, on
obtient des résultats positifs après un délai de 12 à 18 mois dans
80 % des cas.
En pratique clinique, trois situations peuvent se rencontrer : acou-
phènes sans hyperacousie, acouphènes avec hyperacousie, acou-
phènes avec déficience auditive subjective. La prise en charge en
fonction de chacune de ces situations est résumée dans le
tableauIII. Les points importants sont de toujours traiter l’hyper-
acousie en premier, d’obtenir une égalité de sensation sur les deux
oreilles, de prendre en compte une déficience auditive subjective
quels que soient les résultats de l’audiogramme. Enfin, la déli-
vrance et le réglage des générateurs restent un problème en
France. S’il paraît logique que cette charge revienne aux audio-
prothésistes, ils sont malheureusement très peu à l’heure actuelle
à y être formés.
l’X avec geyser-labyrinthe, le risque de cophose iatrogène chi-
rurgicale est proche des 100 %. Les images tomodensitomé-
triques y sont typiques et montrent une dilatation massive du
conduit auditif interne, qui se jette dans la cochlée, dont les cloi-
sons osseuses ont disparu.
Au terme du bilan, la surdité est de cause extrinsèque, génétique
syndromique, génétique non syndromique, ou un cas sporadique
de cause inconnue. On sait maintenant que les deux tiers des cas
sporadiques au minimum sont des surdités génétiques.
En conclusion, l’intérêt du diagnostic moléculaire des muta-
tions de CX26 dans la pratique quotidienne est d’informer les
parents sur la transmission de la surdité sur le mode autosomique
récessif, sur le caractère peu ou pas évolutif de la surdité, sur la
possibilité de degrés différents de surdité au sein d’une même
famille. Il est préférable que ce soit le généticien qui annonce
le diagnostic à la famille. Enfin, il est tout à fait possible qu’une
thérapie génique soit disponible dans les dix ou quinze ans
à venir.
LES ACOUPHÈNES : CONDUITE À TENIR EN PRATIQUE
(R. Dauman, Bordeaux)
L’acouphène est un son entendu par le sujet et par lui seul.
Hormis certains cas où une étiologie organique est retrouvée,
aucune thérapeutique médicamenteuse n’est venue à ce jour révo-
lutionner son traitement. Dans cette communication, R. Dauman
nous propose un schéma simplifié du modèle neurophysiologique
de Jastreboff et les attitudes thérapeutiques pratiques qui en
découlent.
La relation médecin/malade est à la base de la thérapeutique pro-
posée. L’attente du patient est forte, il faut savoir ajuster notre
attitude à sa demande : capacité d’écoute, gestion du temps, infor-
mations. Il faut soigner un individu et non un organe. Mais, devant
la réputation d’invulnérabilité des acouphènes, le sentiment de
résignation est souvent fort : il faut éviter de le partager avec le
patient. L’important est de convaincre.
La version simplifiée du modèle de Jastreboff nous dit que l’acou-
phène n’est pas produit dans l’oreille mais dans le cerveau, de
manière réactionnelle à un événement traumatisant. Ce modèle
distingue de l’organe neuro-sensoriel qu’est l’oreille deux com-
Tableau II. Bilan étiologique d’une surdité de perception de l’enfant.
Interrogatoire dirigé
Examen clinique
Examens complémentaires
de première intention
Examens complémentaires
sur orientation clinique
Diagnostic moléculaire
Antécédents de l’enfant sourd, âge de la marche, problèmes visuels nocturnes, épisodes d’hématurie.
Antécédents familiaux, surdité, consanguinité.
Signes évoquant un syndrome chez l’enfant sourd ou dans sa famille : mèches blanches et hétérochromie irienne,
anomalies branchiales ou du pavillon, pathologies thyroïdiennes, rénales, malformations.
ORL. Pédiatrique. Ophtalmologique (fond d’œil).
Recherche d’hématurie-protéinurie. ECG (syndrome du QT long).
Tomodensitométrie des rochers.
Électrorétinogramme. Épreuves vestibulaires.
Dosages hormonaux thyroïdiens, test au perchlorate. Échographie rénale ou cardiaque.
Parfois pour les surdités syndromiques. Utile pour les surdités non syndromiques.

ACTUALITÉ
10
La Lettre d’Oto-rhino-laryngologie et de chirurgie cervico-faciale - no254 - juin 2000
Tableau IV. Imagerie dans la pathologie parotidienne.
Tableau III. Prise en charge des acouphènes.
PLACE DES EXPLORATIONS DANS LA PATHOLOGIE
PAROTIDIENNE
(M. Zanaret, Marseille)
Le bilan est complètement différent en fonction de la nature tumo-
rale ou non de la pathologie rencontrée.
Les pathologies non tumorales sont : les parotidites aiguës et
récurrentes, les lithiases parotidiennes, les sialoses (syndrome de
Gougerot-Sjögren) et les sialodénoses (hypertrophie parotidienne
bilatérale, symétrique, asymptomatique). Les parotidites aiguës
ne doivent pas être explorées, elles sont une contre-indication à
la sialographie. Les parotidites récurrentes de l’enfant et de
l’adulte doivent bénéficier d’une sialographie à la recherche d’une
lithiase. Dans la pathologie lithiasique, dont le diagnostic diffé-
rentiel est la parotidite récurrente, l’imagerie est indispensable
pour affirmer et localiser le calcul : l’échographie ne permet de
visualiser que les calculs supérieurs à 4 mm ; la sialographie est
plus sensible. Le syndrome de Gougerot-Sjögren est une affec-
tion auto-immune qui associe œil sec, bouche sèche et connecti-
vite. Le diagnostic, difficile, sera le plus souvent histologique sur
biopsie des glandes salivaires accessoires. Les explorations mor-
phologiques ne sont pas faites systématiquement. Elles sont
d’ordre fonctionnel : scintigraphie et sialographie. Les sialodé-
noses sont de causes métaboliques, nutritionnelles ou toxiques.
Elles sont prises en charge par l’interniste ; les explorations
locales sont sans intérêt.
La pathologie tumorale ne doit plus se concevoir sans une
information de plus en plus précise en préopératoire pour les
patients, particulièrement vis-à-vis du risque de lésion du nerf
facial. L’évolution actuelle, qui permet de fournir au mieux cette
information, s’oriente vers la triple approche : clinique, imagerie,
cytoponction.
L’imagerie dispose de quatre examens : IRM, TDM, échographie,
sialographie, pour répondre à cinq questions : présence ou absence
d’une tumeur, lésion extra- ou intraglandulaire, atteinte du lobe
profond et de l’espace parapharyngé, rapports de la tumeur avec
le nerf facial, approche de la nature histologique.
La place de ces examens en fonction de ces questions est résu-
mée dans le tableau IV. La sialographie n’a plus aucune indica-
tion. L’examen le plus efficace est l’IRM, avant le TDM, puis
l’échographie.
La cytoponction est un examen de plus en plus pratiqué. Sa tech-
nique est simple et peu coûteuse, sans risque pour le nerf facial.
Il n’y a aucun risque de dissémination tumorale. Ses sensibilité
et spécificité varient en fonction des équipes (conditions de pré-
lèvement, techniques biologiques, anatomopathologiste expéri-
menté), pouvant atteindre 90 %. Connaître le diagnostic histolo-
gique en préopératoire est un problème essentiel pour le patient
et le chirurgien, car les risques pour le nerf facial ne sont pas les
mêmes selon le type de la tumeur.
En préopératoire, l’examen clinique seul permet un diagnostic
dans 90 % des cas, et la triple approche dans 95 % des cas. Ne
pas faire d’IRM “à tous” expose à un risque d’erreur supplé-
mentaire de 2 %. À l’heure du consentement éclairé et des pro-
blèmes médico-judiciaires, cette triple approche s’avérera peut-
être obligatoire.
LE CONSENTEMENT ÉCLAIRÉ EN CHIRURGIE
CERVICO-FACIALE
(J.J. Pessey, Toulouse)
La responsabilité médicale est un sujet d’actualité, et le consen-
tement éclairé en est un des principaux acteurs. On observe une
constante augmentation des procès (hausse de 500 % en cinq
ans au CHU de Toulouse, avec 483 plaintes en 1999 ; 400 %
de plaintes supplémentaires dans les services de chirurgie pédia-
trique de Paris), qui s’explique par une évolution dans la men-
talité des patients (“ils veulent tout très vite”), l’augmentation
du nombre d’interventions et le rôle de plus en plus important
des médias. En 1936, l’arrêt Mercier laissait présager les diffi-
cultés actuelles ; il établissait un équilibre entre le droit des
patients et l’obligation des médecins. Désormais, le nouveau
Code de déontologie médicale du 6 septembre 1995 définit les
quatre obligations contractuelles “minima” du médecin : l’obli-
gation de moyens (apporter des soins consciencieux et selon les
Acouphènes 2 générateurs de bruit
sans hyperacousie à niveau suffisant (niveau de mélange)
pendant 12 à 18 mois.
Acouphènes 2 générateurs à niveau modéré :
avec hyperacousie après 4 à 6 mois,
l’hyperacousie est réduite.
Puis niveau de mélange 12 à 18 mois.
Acouphènes avec déficience 2 prothèses amplificatrices
auditive subjective numériques.
Bruit environnant ou générateurs.
Présence ou absence Meilleur examen : IRM.
d’une tumeur Éventuellement : échographie/TDM
(peuvent rassurer à tort).
Localisation Meilleur examen : IRM.
extra- ou intraglandulaire Éventuellement : échographie/TDM.
Atteinte du lobe profond Meilleur examen : IRM.
et de l’espace parapharyngé Éventuellement : TDM.
Insuffisance de l’échographie.
Rapport de la tumeur Meilleur examen : IRM
avec le nerf facial (le nerf n’est pas visible,
mais on peut localiser
la tumeur en endo- ou exofacial).
Éventuellement : TDM
(on voit l’artère et la veine faciales,
qui sont de bons repères).
Approche de la nature Meilleur examen : IRM.
histologique Le TDM permet l’identification
de certaines variétés tumorales :
lipomes, hémangiomes,
cystadénolymphomes ?
Bilan d’une récidive Meilleur examen : IRM.

11
La Lettre d’Oto-rhino-laryngologie et de chirurgie cervico-faciale - no254 - juin 2000
données récentes de la science), une mise à jour constante des
connaissances, la notion de primum non nocere, l’information
et le consentement libre et éclairé. C’est sur le manquement
dans le dossier médical de ce dernier point que la majorité des
procès sont intentés.
Le contenu de l’information doit être loyal, clair, approprié et
accessible. Il doit décrire la pathologie, son évolution prévisible,
et les investigations, la nature et les conséquences du traitement,
les alternatives thérapeutiques, les suites “normales”, les compli-
cations et les risques.
Désormais, tous les risques doivent être expliqués aux patients,
notamment les risques graves aux conséquences mortelles (dire
à tous les patients qu’ils peuvent mourir), invalidantes et esthé-
tiques (la chirurgie cervico-faciale y est particulièrement expo-
sée : perte de la fonction auditive ou visuelle, sections nerveuses).
Les risques exceptionnels sont évoqués, de même que les incon-
vénients (chirurgie esthétique ++). Un défaut d’information sur
un risque grave engage la responsabilité civile du médecin, ce
qui n’est pas le cas pour un risque banal.
Les limites au consentement éclairé sont l’urgence avec danger
immédiat et la limitation thérapeutique de l’information, c’est-
à-dire lorsque l’on a l’impression que dire toute la vérité donne
moins de chances au patient. Mais, dans ce dernier cas, il faut
écrire les raisons de notre démarche au médecin traitant et les
consigner dans le dossier médical.
En ce qui concerne les enfants, il faut obtenir le consentement
d’un seul parent en cas d’intervention simple et des deux en
cas d’intervention grave. Pour une urgence sans la présence
des parents, l’avis et l’accord du directeur de l’hôpital ou de la
clinique et de deux médecins sont nécessaires. Lorsque les
parents sont divorcés, il faut demander lequel est le tuteur
légal. Enfin, pour les situations difficiles (intervention néces-
saire mais parents divorcés d’avis divergents, par exemple), il
ne faut pas hésiter à écrire au juge des enfants avec accusé de
réception.
Pour la chirurgie esthétique, il y a une obligation de moyens “ren-
forcée”, une obligation rigoureuse de prudence et de conseil, une
information “draconienne”, un délai de 15 jours à respecter, un
devis préopératoire à faire.
Au moment du procès, cinq moyens existent d’apporter la preuve
que l’on a bien informé le patient : l’écrit, le témoignage (par une
personne qui ne fait pas partie du service et qui n’est pas de la
famille...), la présomption (nombre de consultations avec le
patient, écrits au médecin généraliste et dans le dossier médical),
l’aveu, le serment. En pratique, il ne reste que les écrits lors d’un
procès.
La base préliminaire à toute chirurgie doit donc impérativement
comporter une fiche d’information, et la preuve de sa délivrance
au patient par une signature sur une feuille à part. Les dossiers
médicaux doivent être tenus à jour (les experts sont le plus sou-
vent contraints de se reporter au dossier médical infirmier...). La
transmission entre médecins doit être systématique.
Pour finir, l’information ne doit pas être une décharge de res-
ponsabilité, la preuve ne doit pas parasiter la confiance, mais
information et preuve font désormais partie intégrante de notre
exercice.
ÉTATS PRÉCANCÉREUX ET CANCERS LIMITÉS
À UNE CORDE VOCALE
(C. Beauvillain, Nantes)
Cette communication fait une revue des différents traitements pos-
sibles pour des cancers de corde vocale classés T1a ou T1s et pour
les kératoses.
Sur un plan anatomique, il est important de se rappeler les moda-
lités d’extension de ces cancers : en surface muqueuse (com-
missure antérieure, sous-glotte, face supérieure de la corde
vocale), en profondeur (muscles, ligament, espace paraglottique,
aile thyroïdienne, membrane thyroïdienne, cône élastique, com-
missure antérieure et corde vocale opposée, aryténoïde en arrière).
L’extension ganglionnaire est rare, l’étage glottique n’ayant pas
de drainage lymphatique.
Les circonstances de la découverte des cancers glottiques et
des états précancéreux sont les mêmes : il s’agit de la dyspho-
nie persistante et de la toux d’irritation. L’examen clinique com-
porte la laryngoscopie indirecte (qui donne la meilleure qua-
lité d’image), la nasofibroscopie, la stroboscopie (dans les cas
difficiles), la palpation du larynx et de l’espace intercrico-
thyroïdien, la recherche d’adénopathies cervicales. L’examen
endoscopique sous anesthésie générale se fait si possible en
ventilation spontanée. Il s’aide d’optiques à 30°, contrôle la
corde vocale saine, recherche une seconde localisation et per-
met la biopsie et/ou l’épluchage de la lésion. Ce dernier doit
être complet (il doit aller jusqu’aux muscle et ligament) et
orienté autant que possible. En effet, une kératose peut dissi-
muler une dysplasie légère à sévère, mais aussi un véritable can-
cer. Si tel est le cas, un épluchage a minima ne le diagnosti-
quera pas. La mobilité ou la fixité de la corde vocale sont
minutieusement recherchées en ventilation spontanée, en gar-
dant à l’esprit qu’une corde vocale de mobilité diminuée mais
avec un aryténoïde mobile met la tumeur en T2 et non en T3.
Chaque examen endoscopique se conclut par un schéma daté
des lésions constatées.
Les diagnostics différentiels à évoquer sont le polype ou nodule
vocal, la papillomatose laryngée, le papillome corné, la tubercu-
lose laryngée ainsi que les autres tumeurs bénignes.
Les traitements possibles d’un T1a de la corde vocale sont la
cordectomie chirurgicale, la radiothérapie, la cordectomie laser
et le laser PDT. La chimiothérapie exclusive est proposée par
certaines équipes. Elle permet une excellente préservation de la
qualité vocale, et sera peut-être une thérapeutique à proposer dans
l’avenir. Ces différentes thérapeutiques sont résumées dans le
tableau V. La cordectomie laser a actuellement la préférence de
la plupart des auteurs.
Devant un épithélioma in situ (dysplasie sévère), l’attitude est
discutée : soit un épluchage simple (attention au deuxième côté !),
soit une cordectomie laser superficielle muqueuse.
En présence d’une kératose, il faut pratiquer un épluchage complet
de la corde vocale et vérifier la corde controlatérale au microscope.
Enfin, la laryngectomie fronto-latérale garde encore sa place,
mais dans des indications bien précises : cancer de la corde
vocale unilatéral atteignant le tiers antérieur, jouxtant la
commissure antérieure sans l’envahir, avec un TDM proche de
la normale.
 6
6
1
/
6
100%