Lire l'article complet

Il est raisonnable aujourd’hui de ne plus at-
tendre de traitement miracle, compte tenu de
la diversité des cancers et de l’importance de l’in-
dividualité des “terrains” propices au déclen-
chement de la maladie. Les spécialistes axent
donc leur réflexion sur la qualité de vie des
malades. L’implication de ces derniers est à
l’ordre du jour. La parole leur est donnée (Euro-
cancer 99) et l’information qui leur est due
semble devenir une règle admise, notamment en
France, à la suite des États généraux de la santé.
L’évolution de la communication a rendu le pa-
tient adulte, un patient qui, lorsqu’il se prend en
charge, optimise son traitement. Cette évolution
relationnelle entre le malade et les soignants en-
gage un partenariat favorable au bon déroule-
ment des soins. Assurer une qualité de soins op-
timale aux patients atteints de cancer, c’est ce qui
est ressorti des interventions faites à l’ASCO. En
résumé, un accent particulier doit être mis sur la
formation des praticiens à la prise en charge
symptomatique des patients, ainsi qu’à leur ap-
proche psychologique. De même, une place de
plus en plus large doit être offerte aux associa-
tions de patients les plus représentatives afin que
les malades puissent exprimer leur vécu, attitude
susceptible d’orienter le soin vers la qualité.
Une étude a été entreprise aux États-Unis, ayant
pour but d’apprécier la pertinence des traitements
réalisés, l’éventuelle participation à des essais cli-
niques, l’information donnée aux patients et la
perception par celui-ci de son traitement.
C’est donc dans l’instauration d’un véritable par-
tenariat entre soignants et patient que réside le
concept de qualité car il est de plus en plus cer-
tain que l’on ne soigne plus un “cancer” mais un
“patient atteint d’une maladie grave”. L’objectif
est de prendre en charge le malade dans son en-
vironnement social et culturel avec son patri-
moine propre. C’est ce concept de soins qui le
fera guérir ou, à défaut, optimiser le pronostic
en l’aidant à vivre le plus longtemps possible,
autonome et sans trop de souffrance et d’effets
secondaires handicapants.
Cancer du poumon
Le cancer du poumon représente la pre-
mière cause de mortalité aux États-Unis,
Sommaire
• Thérapie génique :
un traitement
prometteur
• Lutte contre le cancer :
un programme national
• Sénologie :
un “plus”
pour les patientes
• Suivi ambulatoire :
des fonctions multiples
• La psycho-oncologie :
une spécialité
àpart entière
• Douleur : des progrès
dans la prise en charge
Cancer
Une meilleure application
des traitements existants
La 36eédition de l’ASCO
(American Society of Clinical Oncology)
s’est déroulée
du 20 au 23 mai 2000
àLaNouvelle-Orléans (États-Unis).
Les professionnels du monde entier
ont communiqué sur les progrès
thérapeutiques et les différentes
orientations possibles dans
le traitement des cancers. Cette
année, peu de nouveautés. Surtout
des confirmations de l’efficacité de molécules ou de protocoles
déjà connus. Et priorité à la qualité de vie du malade.
13
●●●

14
Cancer
tuant 160 000 personnes en 1999, c’est-à-
dire plus que le cancer du sein, du côlon et de la
prostate réunis. Les résultats d’une étude de
l’ECOG (Eastern Cooperative Oncology Group) re-
groupant 1 207 patients étaient donc particuliè-
rement attendus.
Quatre associations de chimiothérapie ont été
comparées en première ligne (cisplatine-paclitaxel,
cisplatine-gemcitabine, cisplatine-docetaxel et
carboplatine-paclitaxel). Les taux de réponses
de ces quatre associations ont été très voisins
(respectivement 21,3 %, 21 %, 17,3 % et 15,3 %)
et décevants par rapport aux résultats des études
de phase II. Aucune différence n’a été observée
en termes de survie globale tant chez les patients
atteints de tumeurs de stade III que chez les pa-
tients atteints de tumeurs de stade IV. Toutefois,
la survie à un an dans tous ces protocoles (31 à
36 %) est supérieure à celle observée ces dix
dernières années chez des malades suivant des
traitements classiques (20 à 25 %).
Si aucune de ces associations de chimiothérapie
ne semble se distinguer des autres en termes
d’efficacité, leurs profils de tolérance sont cepen-
dant différents. La bonne tolérance de l’associa-
tion paclitaxel-carboplatine notamment peut
être soulignée.
Cette étude ne bouleversera sans doute pas la
pratique clinique mais permettra de choisir un
protocole en fonction de sa tolérance, de son
coût, et de la situation clinique du patient.
L’ avenir est sans doute dans l’association de trois
molécules, les associations sans cisplatine et les
associations avec des molécules visant d’autres
cibles biologiques telles que l’angiogenèse. En
outre, les données de la pharmacogénomique
permettront peut-être de sortir de l’ère des trai-
tements empiriques au profit des traitements
choisis en fonction des caractéristiques biolo-
giques de la tumeur.
Cancer du col de l’utérus
La multiplication des essais entraînerait-il des ré-
sultats contradictoires ? C’est en effet la seule ex-
plication logique aux résultats du NCI (National
Cancer Institute) canadien concernant la radiochi-
miothérapie dans les cancers du col avancés.
Conduit sans défaut méthodologique, cet essai
donne des résultats contradictoires par rapport
aux cinq essais antérieurs ayant démontré l’intérêt
de cette même radiochimiothérapie. Il n’y a donc
pas, selon le Pr Éric Pujade-Lauraine (Hôtel-Dieu,
Paris), de remise en cause de ce standard théra-
peutique, mais un constat peut être fait : la multi-
plication des essais augmente le risque de retrou-
ver des résultats contradictoires !
Cancers digestifs
D’après les intervenants, aucune nouveauté ne
viendra cette année modifier la pratique cli-
nique dans le domaine des cancers digestifs.
Les premières études comparant 5-FU plus
acide folinique en bolus et 5-FU en perfusion
continue, dans les traitements adjuvants des
cancers coliques, montrent des résultats inté-
ressants en termes de tolérance mais trop peu
matures en termes de résultats.
Les études adjuvantes dans les cancers gas-
triques et pancréatiques restent décevantes. Les
combinaisons de nouvelles molécules en situa-
tion métastatique sont prometteuses, sans plus,
selon le Dr Christophe Louvet (hôpital Saint-
Antoine, Paris).
Ici encore, ce sont les nouvelles cibles qui sem-
blent représenter l’avenir de la prise en charge
des cancers digestifs la patience semble devoir
être de rigueur...
Dépistage du cancer colorectal :
vers la coloscopie virtuelle
C’est au congrès de l’AGA (21-24 mai, San Diego)
que Rochester a proposé une nouvelle approche
révolutionnaire et non invasive de la coloscopie
virtuelle, permettant de détecter des polypes d’un
centimètre. Le principe consiste en l’absorption de
baryte durant les trois jours précédant l’examen, le
traitement de l’image scannographique permet-
tant ensuite la soustraction de tout ce qui est ma-
tière fécale dans le côlon. Des études compara-
tives, prospectives et réalisées en double aveugle,
sont bien entendu nécessaires afin d’évaluer la
sensibilité et la spécificité de cette méthode.
Radiofréquence : une avancée dans le traitement
de l’hépatocarcinome
Pour le Pr Pierre Louis Fagniez (hôpital Henri-
Mondor, Créteil), les résultats obtenus par une
équipe japonaise dans le traitement par radiofré-
quence du carcinome hépatocellulaire (lésions de
moins de 5 cm) sur cirrhose (stades A et B) sont
très prometteurs. Les récidives sont en effet
●●●
©Dr Amar-Phanie

moins fréquentes et moins précoces qu’à la
suite d’une alcoolisation percutanée. La tolé-
rance est excellente, mais le recul est insuffisant
pour retrouver des bénéfices en termes de sur-
vie. Des études complémentaires randomisées
sont donc attendues, comparant notamment ra-
diofréquence et chirurgie.
Cancer du sein
La tendance va vers un traitement plus court
mais tout aussi efficace. En effet, selon le NSABP,
les femmes ayant un cancer du sein sans atteinte
ganglionnaire pourraient bénéficier d’une chi-
miothérapie associant adriamycine et cyclo-
phosphamide délivrée sur trois mois (4 cures)
qui donne des résultats identiques à ceux d’un
traitement de six mois de CMF (12 cures).
En ce qui concerne l’hormonothérapie versus
chimiothérapie dans les cancers du sein de bon
pronostic, une étude prospective adjuvante ran-
domisée a été présentée par le Pr Henri Roché
(institut Claudius-Regaud, Toulouse), compa-
rant, après la chirurgie, chez des femmes pré-
ménopausées, trois ans d’un traitement compre-
nant un agoniste de la LH-RH (la triptoréline) +
30 mg de tamoxifène et une chimiothérapie de
type FEC 50, toutes les trois semaines à six re-
prises. Les patientes avaient toutes un cancer du
sein de bon pronostic (moins de trois ganglions
envahis) et au moins un récepteur positif.
Avec un suivi de 54 mois, il n’y a pas de diffé-
rence significative en termes de survie sans réci-
dive. En revanche, le temps jusqu’à rechute est
nettement plus court dans le bras chimiothéra-
pie. Il est par ailleurs intéressant de noter que
50 % des patientes retrouvent un cycle normal
après l’arrêt du traitement hormonal alors que
40 % des patientes traitées par chimiothérapie
connaissent une aménorrhée définitive.
Des études prospectives évaluant la qualité de
vie sont indispensables, mais il est d’ores et déjà
possible de proposer ces deux types de traite-
ments, notamment aux patientes qui refusent la
chimiothérapie.
Nouvelles approches thérapeutiques
Aujourd’hui, il s’agit essentiellement de trouver
de nouvelles cibles de traitement. Ainsi, le concept
de traitement anti-angiogénique a trouvé une va-
lidation dans une étude randomisée présentée par
De Vore (Nashville, États-Unis). Un anticorps mo-
noclonal neutralisant le VEGF (Vascular endothe-
lial growth factor) délivré à hautes doses permet
pratiquement de doubler le temps jusqu’à réci-
dive de tumeurs bronchiques traitées par chimio-
thérapie (7,4 mois versus 4,3 mois). Un risque hé-
morragique grave, survenu chez des patients
atteints de tumeurs épidermoïdes doit cependant
être prévenu par la sélection et la surveillance ri-
goureuse des patients. La transmission du signal
prolifératif à partir du récepteur du VEGF peut
être bloquée par des agents tels que l’Iressa®ou
l’anticorps monoclonal IMC-C225.
Ces nouvelles thérapeutiques émergentes doi-
vent venir compléter, voire remplacer des traite-
ments plus classiques dans un avenir proche.
Des essais de phase III débutent déjà.
Traitement symptomatique
Une étude concernant la prise en charge des
bouffées de chaleur chez les patientes atteintes
de cancer du sein a connu les honneurs de la ses-
sion plénière : c’est dire l’importance accordée à
la qualité de vie lors de cette réunion.
Les bouffées de chaleur sont un symptôme fré-
quent (40 %) qui altère la qualité de vie des pa-
tientes au cours du traitement du cancer du sein,
parfois à long terme (3 ans). Dans une étude ran-
domisée, la venlafaxine à la dose de 75 mg/jour,
molécule habituellement utilisée dans le traite-
ment de la dépression, réduit de 61 % la survenue
de ce symptôme handicapant. L’usage de ce type
de molécules paraît être une alternative aux traite-
ments hormonaux souvent contre-indiqués chez
ces patientes.
Pour conclure, cette année, lors du congrès de
l’ASCO, pas ou peu d’études présentées sur les
intensifications de doses, pas de “scoop” venant
modifier radicalement la pratique clinique. Tout
juste un infléchissement “idéologique” vers une
plus grande attention accordée à la qualité de vie
des patients et à une prise en charge symptoma-
tique. Fait nouveau, certaines associations de pa-
tients étaient présentes à la table des orateurs,
signe que la voix des patients est sinon écoutée,
du moins entendue !
Propos recueillis par Sarah Haïlé-Fida
en collaboration
avec le comité de rédaction de
La Lettre du Cancérologue
15
©Joubert-Phanie

16
Cancer
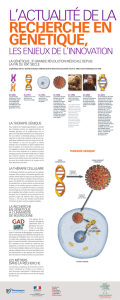
La thérapie génique a généré de formidables espoirs
dans le traitement de certains cancers. Aujourd’hui, à cause
d’“incidents” signalés aux États-Unis, la prudence est de règle.
Et aucune thérapie n’est exploitable à ce jour. Le seul succès est
celui d’une équipe française sur le DICS-X qui concerne les enfants
atteints d’une grave déficience immunitaire à la naissance.
Thérapie génique
Un traitement prometteur
La thérapie génique est une approche thérapeu-
tique visant à modifier le capital génétique de
cellules humaines dans le but, soit de corriger une
anomalie génétique préexistante, soit de modifier
le comportement des cellules par l’introduction
d’un gène étranger. La faisabilité de ce transfert de
gènes dans des cellules a été très largement dé-
montrée sur des modèles animaux depuis cinq ans.
Si les résultats expérimentaux sont encourageants,
le principal enjeu des années à venir consiste à sa-
voir si les études de thérapie génique chez
l’homme, encore aux stades initiaux, peuvent trou-
ver leur application. Deux applications potentielles
sont actuellement en cours d’évaluation clinique :
–les maladies génétiques congénitales (muco-
viscidose, myopathies, désordres immunitaires
par exemple), au cours desquelles la thérapeu-
tique a pour objet de corriger un déficit géné-
tique congénital. Dans cette optique a été ré-
cemment créé un centre de thérapie génique à
l’hôpital Necker-Enfants malades ;
–les affections malignes, et notamment les can-
cers, au cours desquelles la thérapeutique a pour
but de modifier soit les cellules tumorales elles-
mêmes, soit les cellules du système immunitaire.
La thérapie génique, dans le domaine du cancer,
se heurte encore à plusieurs problèmes :
–celui d’identifier les meilleurs gènes candidats
à une manipulation génétique ;
–celui de trouver les meilleurs “vecteurs” pour in-
troduire ces gènes dans les cellules visées par le
traitement ;
–enfin des questions éthiques se posent, au
moins en théorie.
Gènes thérapeutiques et cancer
Le développement d’un cancer chez l’homme se
fait en plusieurs étapes dont les deux principales
sont la prolifération anarchique d’une population
cellulaire et la non-reconnaissance par le système
immunitaire de cette prolifération anarchique. Il
paraît donc logique d’essayer d’agir sur ces deux
composantes. En fait, et de manière schématique,
trois types de manipulations géniques sont pos-
sibles : en premier lieu, le renforcement du sys-
tème immunitaire, ensuite l’introduction d’un
“gène suicide”, enfin la restauration d’un compor-
tement normal des cellules cancéreuses :
•Le renforcement du système immunitaire est ac-
tuellement l’approche la plus utilisée. Ainsi, à la fin
de l’année 1996, sur les 169 protocoles de théra-
pie génique du cancer approuvés aux États-Unis,
la moitié utilise cette approche. Cela peut consis-
ter à modifier les cellules tumorales pour les
rendre plus faciles à reconnaître par le système im-
munitaire. De nombreux gènes sont utilisés dans
ce but, notamment ceux de l’interleukine 2, du
GM-CSF ou d’autres cytokines, substances qui in-
terviennent dans les phénomènes de reconnais-
sance puis de destruction des cellules tumorales
par le système immunitaire. Ce peut être aussi le
fait de modifier les cellules du système immuni-
taire (lymphocytes, fibroblastes, cellules dendri-
tiques), cellules qui interviennent à l’une des
étapes de la reconnaissance immunitaire.
•L’introduction d’un gène suicide est une approche
séduisante qui consiste à introduire dans les cellules
tumorales un gène qui les rend sensibles à un trai-
tement peu ou pas actif sur les cellules normales.
Ainsi l’introduction du gène TK (thymidine kinase)
du virus herpès dans des cellules humaines rend
celles-ci capables d’utiliser une molécule antivirale,
le ganciclovir, pour s’autodétruire (d’où le terme de
gène suicide). D’autres gènes permettent de trans-
former un antibiotique en une chimiothérapie ac-
tive au niveau de la cellule tumorale.
•La restauration d’un comportement normal des
cellules est la dernière approche qui consiste à mo-
difier le comportement anormal de la cellule tu-
morale. Le meilleur exemple de cette approche est
l’utilisation de gènes “suppresseurs de tumeurs”.
C’est le cas du gène p53, gène capable, dans ●●●

18
Cancer
les cellules normales, de contrôler la prolifé-
ration et d’induire, en temps voulu, la mort pro-
grammée de la cellule (encore appelée apoptose).
Dans un nombre important de tumeurs, ce gène
est anormal, et les cellules tumorales ne sont plus
capables de contrôler leur prolifération anar-
chique. La réintroduction du gène peut donc per-
mettre un arrêt de ce phénomène et la mort des
cellules tumorales. Des premiers résultats encou-
rageants chez l’homme ont récemment été rap-
portés par le Dr Roth (M.D. Anderson, Houston)
dans le cancer du poumon. A l’inverse, il est pos-
sible d’introduire dans les cellules un gène qui va
contrecarrer les effets néfastes d’un gène anormal :
c’est l’utilisation de gènes “antisens”. Ces gènes
vont donc venir annuler les effets délétères du
gène anormal. Comme on le voit, les approches
théoriques sont nombreuses. Cependant, la théo-
rie se heurte à un problème pratique : comment
amener le gène exclusivement aux cellules visées
(ou cellules cibles) ?
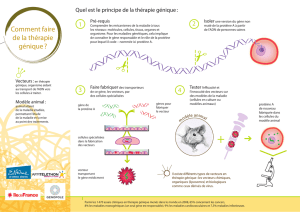
Quels vecteurs utiliser ?
Le problème de la thérapie génique consiste à dé-
livrer aux cellules cibles le gène thérapeutique en-
visagé. En pratique, cela nécessite l’utilisation de
vecteurs, capables de transporter le gène dans la
cellule et de lui permettre de s’intégrer dans le ca-
pital génétique de la cellule. Actuellement, deux
types d’approches sont développées : les vecteurs
viraux et les vecteurs chimiques non viraux. Les
vecteurs viraux comprennent deux types de virus
qui peuvent être utilisés : des virus à ARN et des
virus à ADN.
•Les rétrovirus ont été les premiers utilisés. D’uti-
lisation simple, ces virus sont composés d’un brin
d’ARN entouré de deux “boîtiers de commande”
permettant d’en contrôler la prolifération. Ils ne
peuvent s’incorporer que dans des cellules se mul-
tipliant rapidement, ce qui est le cas des cellules
tumorales. Par contre, ces virus nécessitent une
“copie ADN” pour pouvoir s’insérer dans le gé-
nome de la cellule, ce qui rend cette insertion plus
aléatoire. Utilisés les premiers en thérapie génique,
ils sont actuellement en partie abandonnés au pro-
fit des virus à ADN.
•Les adénovirus sont actuellement les vecteurs de
choix pour la thérapie génique en cancérologie. En
effet, ces virus à ADN infectent facilement un
grand nombre de cellules humaines. Des adénovi-
rus défectifs, ayant perdu une partie de leur gé-
nome, et notamment leur capacité à se multiplier
et à être pathogènes, peuvent être fabriqués. En
remplaçant les régions du génome ainsi délétées
par le gène que l’on souhaite transférer, on obtient
des adénovirus recombinants très efficaces. Par
contre, les adénovirus étant des hôtes fréquents
chez l’homme, notamment au cours des infections
respiratoires, le risque théorique d’une rencontre
entre un adénovirus “sauvage” et un adénovirus
recombinant, c’est-à-dire porteur d’un gène théra-
peutique, existe. Bien que cette hypothèse n’ait ja-
mais été prouvée, leur utilisation nécessite des
précautions très importantes pour isoler le malade
traité et son environnement (personnel médical,
famille...). Ces contraintes limitent encore leur uti-
lisation à des centres équipés d’unités spécialisées,
capables d’assurer un isolement sans faille. Il est
néanmoins probable que, l’expérience et les résul-
tats des premiers essais cliniques aidant, ces condi-
tions d’isolement très sévères pourront être allé-
gées. D’autres virus sont actuellement en cours
d’évaluation, mais leur capacité de transfert de
gène est inférieure à celle des adénovirus.
En ce qui concerne les vecteurs non viraux, beau-
coup d’équipes essaient de les utiliser pour s’af-
franchir des risques liés à l’utilisation des vecteurs
viraux. Ces vecteurs chimiques non viraux sont des
lipides, des protéines, etc. Cependant, le pourcen-
tage de cellules “infectées” par ces vecteurs reste
très faible, et leur développement en thérapeutique
passe par une amélioration de ce transfert de gène.
Florence Sebaoun
D’après une communication du Dr Bernard Escudier, chef de l’unité
d’immunothérapie de l’Institut Gustave-Roussy (Villejuif, 94).
Problèmes éthiques et risques théoriques
Sur le plan éthique, le développement du génie génétique néces-
site un contrôle rigoureux par les comités d’éthique afin d’éviter
des déviations dangereuses. Les risques théoriques de la thérapie
génique sont actuellement très limités par l’utilisation de précau-
tions draconiennes, d’une part au niveau de l’acceptation des nou-
velles études de thérapie génique (ce qui constitue actuellement un
véritable parcours du combattant), d’autre part au niveau du risque
de contamination de l’environnement (pour les adénovirus). Un
autre risque est immunologique. En effet, l’introduction de gènes
étrangers dans l’organisme, notamment à l’aide de virus, peut en-
traîner une réaction de rejet de l’organisme. Ce risque est particu-
lièrement vrai dans le cadre des maladies génétiques où il est né-
cessaire que le gène transféré puisse s’exprimer de manière
durable. En matière de thérapie anticancéreuse, au contraire, ce
risque peut se transformer en bénéfice. Si la tumeur a pu être éra-
diquée avant le développement du rejet, le risque le plus important
est celui de l’inefficacité thérapeutique liée à un transfert insuffi-
sant du matériel génétique transféré aux cellules cibles. En effet, les
résultats précliniques très encourageants sont encore difficiles à re-
produire chez l’homme, compte tenu de la difficulté à “infecter”
un nombre suffisant de cellules. De ce fait, un risque serait de tirer
des conséquences trop hâtives de résultats cliniques négatifs, uni-
quement dus à un transfert insuffisant de matériel génétique.
●●●
 6
6
1
/
6
100%