Le syndrome de tako-tsubo

Le syndrome de tako-tsubo
(syndrome de baLLonnisation
apicaLe transitoire du ventricuLe
gauche) : nouveLLe cardiopathie
péri-opératoire ?
Claude Lentschener
Service d’Anesthésie-Réanimation, Hôpital Cochin, 27 rue du Faubourg
Saint Jacques - 75014 Paris
INTRODUCTION
Le syndrome de tako-tsubo, souvent dénommé «syndrome de ballonnisation
apicale transitoire du ventricule gauche», se présente cliniquement, électrocar-
diographiquement et biologiquement comme un syndrome coronarien aigu alors
qu’aucune obstruction des artères coronaires sus-épicardiques ne peut en rendre
compte [1-14]. Un stress aigu sévère, émotionnel ou physique, est identifié,
le plus souvent, dans les heures qui précèdent les signes cliniques [1-14]. La
morphologie du ventricule gauche dyskinétique (Figure 1), évoque la forme
du tako-tsubo, qui est le pot à fond rond et col étroit dans lequel les pêcheurs
japonais piègent les pieuvres (Figure 2) [1-14]. Le syndrome de tako-tsubo est
considéré dans les revues les plus récentes comme une entité unique qui
inclut les dyskinésies transitoires du ventricule gauche rapportées au cours des
hémorragies sous arachnoïdiennes et du phéochromocytome [15-18].
Figure 1 : ventriculographie en fin de systole montrant l’aspect de ballonisation
apicale associée à l’hyperkinésie de la partie basale du ventricule gauche.

MAPAR 2008
74
Figure 2 : le tako-tsubo.
2. CIRCONSTANCES DU DIAGNOSTIC
Une douleur précordiale constrictive, aigue, médiane est la première plainte
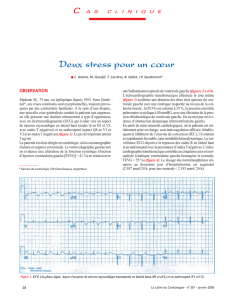
rapportée par 70 % des patients [1-14]. Les anomalies de l’électrocardiogramme
(ECG) évoquent un accident coronarien aigu (Figure 3) [1-14]. Elles associent des
troubles de la repolarisation : sus-décalage ou sous-décalage du segment ST,
ondes T négatives [1-14]. Les anomalies siègent dans les dérivations gauches
ou sont diffuses et non systématisées [1-14]. La présence d’une onde Q durant
quelques jours a été rapportée [1, 2]. L’allongement de l’intervalle QT est rap-
porté dans près de 100 % des cas [1-14]. L’ECG peut être normal les premières
heures et les modifications électrocardiographiques peuvent être décalées dans
le temps [1, 2, 5, 10]. Les taux sériques des enzymes cardiaques, CPK-MB et
troponines I ou T sont modérément élevés chez 73 % et 86 % des patients
publiés, respectivement [1-14]. Ces taux sont moins élevés que le suggèrent
l’intensité de la douleur précordiale et l’extension des signes ECG [1-14]. Il n’y a
pas de syndrome inflammatoire biologique [1-14]. La NFS n’est pas modifiée [1-
14]. Une grande variété de stress psychologique ou physique a été identifiée
dans les heures qui précèdent ce syndrome chez 96 % des patients, tels un
conflit conjugal, un accident de la voie publique, le décès d’un proche, un rapport
sexuel, des problèmes professionnels, un pneumothorax, un ECG d’effort, une
intoxication médicamenteuse, une réaction anaphylactique, une hospitalisation
en réanimation, mais aussi des interventions chirurgicales de gravité diverse :
chirurgie cardiaque sous circulation extracorporelle, pose d’une prothèse de
hanche, thyroïdectomie, appendicectomie [1-14]. Un syndrome de tako-tsubo a
été induit par la contrainte chez l’animal de laboratoire [19].
3. CORONAROGRAPHIE ET VENTRICULOGRAPHIE
L’angiographie des artères coronaires et la ventriculographie sont les exa-
mens clés pour le diagnostic [1-14].
3.1. CORONAROGRAPHIE DEMANDÉE EN URGENCE
La coronarographie demandée en urgence, dans ce contexte évocateur de
pathologie coronarienne aigue, ne montre pas de sténose coronarienne signifi-

Le cœur en anesthésie-réanimation 75
cative susceptible de rendre compte des troubles [1-14]. Le test de provocation
du spasme coronarien est négatif dans plus de 50% des cas rapportés [1-14].
3.2. VENTRICULOGRAPHIE
La ventriculographie confirme les données de l’échographie cardiaque [1-14].
La fraction d’éjection moyenne du ventricule gauche a été rapportée entre 20 %
à 49 % ; l’akinésie de la partie distale du ventricule gauche s’accompagne d’une
hyperkinésie de sa partie basale [1-14]. Typiquement au moment de la systole,
on observe une ballonnisation apicale du ventricule gauche qui apparait dilaté
contrastant avec le rétrécissement du segment basal qui apparaît hyperkinétique
(Figure 1) [1-14]. Le ventricule gauche ballonnisé en fin de systole prend l’aspect
du tako-tsubo qui est un pot à fond rond et col étroit utilisé par les pêcheurs
japonais pour piéger les pieuvres (Figure 2)[1-14]. Ces troubles cinétiques ne sont
pas systématisés à un territoire artériel coronaire précis [1-14]. Ils ont disparu
chez tous les patients qui ont survécu à la phase aigue [1-14].
4. PRÉSENTATIONS ATYPIQUES
4.1. DOULEURS ABSENTE OU ATYPIQUE
Chez quelques patients, la douleur est absente ou atypique évoquant une
pathologie digestive [4]. Une des complications développées plus bas, peut
révéler le syndrome [1-3, 6, 8, 9, 11, 12]. Parfois, il sera diagnostiqué lors de sa
recherche systématique chez des patients exposés [15, 16, 18, 20].
4.2. BALLONNISATION DU VENTRICULE GAUCHE
La ballonnisation du ventricule gauche peut être partielle n’intéressant pas
tout l’apex [7].
4.3. SYNDROMES DE TAKO-TSUBO NON RECONNUS
Des syndromes de tako-tsubo n’ont pas été reconnus en pratique clinique,
en dehors d’une recherche systématique, chez des patients sédatés et/ou si les
signes de la maladie causale étaient au premier plan, par exemple chez le patient
hospitalisé en réanimation pour une autre pathologie [20].
5. EPIDÉMIOLOGIE
Le syndrome de tako-tsubo affecte les femmes 90 fois sur cent [1-14]. L’âge
moyen des patients atteints est de 58 à 77 ans avec des extrêmes rapportées
Figure 3 : syndrome de tako-tsubo. ECG à la phase aigue.

MAPAR 2008
76
de 10 à 89 ans [1-14]. Les pathologies pré-existantes associées, liées au terrain,
ont une prévalence identique à celle d’une population du même âge [1-14].
La fréquence du diagnostic est conditionnée par le taux de coronarographies
dans une unité de soins intensifs de cardiologie [1, 2]. Les évaluations sont
concordantes et montrent que 1,1 % à 2,2 % des patients conduits en salle de
coronarographie pour explorer un sus décalage ECG du segment ST ont en fait
un syndrome de tako-tsubo [1, 2, 5, 8, 10].
6. EVOLUTION ET COMPLICATIONS
Les auteurs s’accordent pour écrire que le pronostic de la maladie est bon
avec récupération complète de la fonction cardiaque une fois que la phase aigue
est passée [1-14]. Néanmoins, de nombreuses complications, parfois menaçan-
tes pour la vie du patient, sont rapportées dans les séries publiées et dans de
nombreux cas cliniques, ce qui permet de dire aujourd’hui que les complications
graves de cette affection ne sont pas anecdotiques et que le pronostic vital peut
être engagé à la phase aigue [1-14]. Trois (1,1 %) des 286 premiers patients
publiés dans la littérature médicale sont décédés durant leur hospitalisation [2].
Des hypotensions, des chocs cardiogéniques ayant nécessité le recours à une
assistance circulatoire pharmacologique et/ou mécanique, des œdèmes aigus
du poumon, des thromboses du ventricule gauche, des embolies vasculaires
cérébrales, une rupture du ventricule gauche, des troubles du rythme cardiaque
et/ou de la conduction ayant nécessité la mise en place d’un entraînement
électro-systolique ont été rapportés [1, 3, 5, 6, 8, 9, 11, 12]. Des syndromes
de tako-tsubo ont récidivé chez un même patient [1, 2]. Des auteurs ont émis
l’hypothèse que des morts subites cliniquement inexpliquées pouvaient avoir
été dues à un syndrome de tako-tsubo [2].
7. L’IMAGERIE CARDIAQUE PAR RÉSONANCE MAGNÉTIQUE
NUCLÉAIRE (IRM)
Seule l’imagerie cardiaque par résonance magnétique nucléaire peut
prédire la capacité de récupération du myocarde altéré [21]. L’IRM est réalisée
après l’administration intraveineuse de gadolinium [21]. Les clichés précoces
permettent une analyse morphologique, la mesure de la fraction d’éjection du
ventricule gauche et des volumes circulants, et la confirmation de la dysfonction
antéro-apicale du ventricule gauche [21]. Les clichés tardifs montrent l’absence
d’hyperfixation myocardique indiquant l’absence de lésions myocardiques
irréversibles et éliminent formellement un autre diagnostic principalement une
myocardite ou un infarctus du myocarde [21].
8. TRAITEMENT
Il n’existe aucune donnée publiée susceptible d’orienter le traitement de
ce syndrome sur une base «scientifiquement prouvée». Les patients sont
habituellement pris en charge comme les patients atteints d’un syndrome
coronarien aigu [1, 2, 5, 8, 10]. Un inhibiteur de l’enzyme de conversion est
administré pour prévenir ou traiter une insuffisance ventriculaire gauche. Un
bêtabloqueur est administré pour prévenir les troubles du rythme cardiaque
et les récidives. Un traitement antiagrégant plaquettaire, associé si nécessaire

Le cœur en anesthésie-réanimation 77
à un traitement anticoagulant, est administré pour prévenir les complications
thrombo-emboliques [1, 2, 5, 8, 10].
9. MÉCANISME
Les études et observations antérieures ont établi ce qui suit [1-14, 20-25].
Il n’y a pas d’obstacle à l’éjection du ventricule gauche sur l’angiographie [1-14].
Le syndrome de tako-tsubo n’est pas expliqué par l’obstruction des artères
coronaires sus-épicardiques [1-14,21]. Ce n’est ni une cardiopathie rythmique,
ni une myocardite aigue, ni une péricardite aigue, ni une valvulopathie [1-14, 21].
Le territoire akinétique ne correspond pas à un territoire artériel coronaire [1-
14, 21]. Seuls trois patients [1,4 %] sur les 212 premiers patients publiés ont
eu un spasme spontané d’une artère coronaire au cours de la coronarographie
[1,2,5,8,10]. Le test de provocation pharmacologique d’un spasme coronarien a
été positif chez vingt-quatre (28,6 %) des 84 patients publiés ayant eu ce test [1-
14]. Les taux plasmatiques de noradrénaline, adrénaline, neuropeptide sont plus
élevés chez les patients hospitalisés pour syndrome de tako-tsubo que chez les
patients hospitalisés pour un infarctus du myocarde [1]. Le nombre de séquences
radiologiques nécessaires pour qu’un produit de contraste administré dans les
artères coronaires atteigne la microcirculation coronarienne a été plus important
chez des patients porteurs d’un syndrome de tako-tsubo que chez des patients
témoins, témoignant ainsi d’une altération de la microcirculation coronarienne
au cours du syndrome de tako-tsubo [22]. Un trouble du métabolisme d’un
acide gras marqué et de la captation cellulaire du F-18 fluorodeoxyglucose a été
mis en évidence dans les cardiomyocytes du territoire akinétique des patients
porteurs d’un syndrome de tako-tsubo, montrant une altération secondaire du
métabolisme cellulaire chez ces patients [23, 24]. Les revues les plus récentes
suggèrent que le trouble micro-circulatoire a induit le trouble métabolique [17].
Le stress lié à l’immobilisation chez le rat active le système sympathique
adrénergique, entraîne un sus décalage du segment ST sur l’ECG et une
ballonnisation transitoire du ventricule gauche [19]. Cet état est prévenu par les
blocages adrénergiques α et β [19]. Il existe une haute prévalence du syndrome
de tako-tsubo chez la femme ménopausée [1-14]. Les œstrogènes ont prévenu
la survenue d’un syndrome de tako-tsubo chez les rates ovariectomisées dans
les modèles expérimentaux [19]. Un polymorphisme des gènes affectant la
réponse périphérique aux catécholamines a été mis en évidence, confirmant que
la réponse cardiaque vis-à-vis du stress est individuelle [16, 17]. Des biopsies
myocardiques ont été réalisées chez des patients atteints de ballonnisation
apicale transitoire du ventricule gauche [1, 25]. A la phase aigue, elles ont montré
l’absence de génome viral, la présence dans le cytoplasme des cardiomyocytes
de vacuoles remplies de glycogène évoquant une privation énergétique, la
«désorganisation en bandes» des protéines contractiles des cardiomyocytes,
actine et myosine, l’absence de mort cellulaire ou de lésions irréversibles, une
prolifération collagène et de quelques cellules inflammatoires (macrophages
et T-lymphocytes) dans les espaces interstitiels [1, 25]. Ces altérations avaient
disparu après régression des signes de la maladie [25]. Des lésions identiques
ont été constatées chez l’animal de laboratoire soumis à une perfusion prolongée
de catécholamines [19].
 6
6
 7
7
 8
8
1
/
8
100%