Télécharger le fichier

1
Chapitre 30 : de l’œuf à l’adulte
Le développement embryonnaire conduit à la formation du plan d’organisation de l’animal. Chez la
grenouille, il est suivi par un développement post-embryonnaire qui conduit la larve à la
métamorphose.
Au cours de l’ovogenèse, la femelle stocke dans ses ovocytes de nombreuses protéines (vitellogenèse)
et des ARNm qui sont traduits dans les premières étapes du développement (segmentation). Par
ailleurs, le génome du futur gamète synthétise de très nombreux ARNr et des ARNm qui sont traduits
en histones, protéines ribosomales. Toutes ces molécules sont utilisées jusqu’à la transcription du
génome zygotique qui débute au 12ème cycle de divisions qui marque la transition blastuléenne.
La disposition des ARN et des protéines dans l’ovocyte est à l’origine d’un double gradient qui
spécifie, avant la fécondation, la région antérieure (pôle animal) et la région postérieure (pôle végétatif)
de l’embryon. La future région antérieure correspond à celle qui est pigmentée. L’ovocyte est à
symétrie radiale.
La fixation d’un spermatozoïde sur l’hémisphère animal est à l’origine de la rotation corticale. Le
cytoplasme cortical est réorganisé à la suite d’une rotation de 30°. Il se forme alors un croissant gris, à
l’opposé du point d’entrée du spermatozoïde, qui correspond à la future région dorsale. Le plan de
symétrie bilatérale est maintenant acquis. La région dorsale possède un assortiment particulier de
protéines qui lui confère de nouvelles propriétés. La β-caténine s’accumule alors dans les blastomères
dorso-végétatifs du stade 64 qui constituent le centre de Nieuwkoop dont le fonctionnement est à
l’origine du centre organisateur de Spemann.
Au cours de la segmentation, les divisions cellulaires synchrones conduisent à un embryon de 4096
cellules qui s’est creusé progressivement d’une cavité. À partir du 13ème cycle, les divisions deviennent
moins synchrones et, avec quelque 10 000 cellules, l’embryon est à la fin du stade blastula.
Le suivi des cellules de la blastula au cours du développement a conduit à la réalisation de la carte des
territoires présomptifs. À ce stade, l’embryon est constitué de trois ensembles de cellules : la calotte
animale, la zone marginale, l’hémisphère végétatif. Bien que ces trois ensembles soient constitués de
cellules indifférenciées, elles sont déterminées. La calotte animale donne l’ectoderme, la zone
marginale produit le mésoderme et l’hémisphère végétatif l’endoderme.
La gastrulation débute par la formation d’une encoche dans les blastomères dorso-végétatifs. Des
cellules de forme particulière, les cellules en bouteille, participent à ces mouvements
morphogénétiques qui conduisent les cellules de la zone marginale et de l’hémisphère végétatif à entrer
dans l’embryon. À la fin de la gastrulation, la zone marginale (mésoderme) est collée, par
l’intermédiaire d’une matrice extracellulaire, à la face interne de l’ectoderme dorsal, les cellules de
l’hémisphère végétatif (endoderme) sont collées à la face interne de l’ectoderme ventral. L’embryon
contient quelque 30 000 cellules.
La neurulation correspond à l’apparition d’une fente antéro-postérieure sur la face dorsale de
l’embryon. Cette ligne neurale est à l’origine de l’invagination d’une partie de l’ectoderme, le
neuroderme, qui forme le système nerveux tubulaire. En parallèle, le mésoderme s’étale ventralement
et l’endoderme s’étend vers la face dorsale. L’embryon se présente alors comme trois tubes emboîtés :
l’ectoderme, le mésoderme et l’endoderme qui constitue le futur tube digestif.
L’organogenèse prolonge la neurulation. Au cours de ce stade, les trois feuillets mis en place au cours
des étapes ultérieures s’organisent les uns par rapport aux autres et donnent naissance aux organes.
L’ectoderme se différencie en épiderme et en système nerveux, le mésoderme donne naissance aux os,
aux muscles, au système circulaire, au sang, aux reins et aux gonades. L’endoderme est à l’origine du
tube digestif est des poumons. À ce stade, l’embryon est presque achevé, l’œuf éclot.
Le développement post-embryonnaire qui caractérise les développements indirects est une phase de
croissance qui correspond à la prémétamorphose ; les changements morphologiques sont peu
importants. La durée de cette phase est très variable et dépend des espèces et des conditions du milieu.
Au cours de la prométamorphose, la croissance ralentit, les pattes postérieures se développent, mais la
forme générale du têtard reste inchangée.

2
Les changements spectaculaires surviennent avec la métamorphose dont le début est marqué par la
sortie d’un des membres antérieurs. La queue régresse rapidement, la bouche se fend, les yeux
deviennent saillants. De nombreuses transformations anatomiques se déroulent : modifications du
système respiratoire et circulatoire. La métamorphose constitue l’ensemble des transformations que
connaît une larve avant de devenir un imago. La métamorphose repose sur des histolyses, des
histogenèses et des remaniements tissulaires. Elle correspond à l’utilisation d’un nouveau programme
génétique exprimé sous l’action des hormones thyroïdiennes. Ces transformations changent la larve
aquatique en un animal plus ou moins bien adapté au milieu aérien. L’imago quitte l’eau et y revient
pour la reproduction quelques années plus tard.
Chapitre 31 : quelques modalités du développement des animaux
Avant la fécondation, l’ovocyte possède une symétrie radiale qui est installée au cours de l’ovogenèse.
Les organites, les plaquettes vitellines, les ARN, les protéines sont répartis de manière hétérogène. Ces
éléments définissent des gradients pôle animal-pôle végétatif avec accumulation de déterminants
morphogènes dans l’hémisphère végétatif (Vg1, VegT, β-caténine, GSK-3, Disheveled). L’entrée du
spermatozoïde réorganise la symétrie radiale et modifie la répartition de ces déterminants.
La rotation du cortex induit une asymétrie structurale et moléculaire. C’est ainsi que la β-caténine
s’accumule dans la future partie dorsale de l’embryon (croissant gris). La β-caténine se fixe avec
d’autres facteurs de transcription sur des gènes impliqués dans le contrôle de la division cellulaire. La
rotation du cortex est responsable de la mise en place de l’axe dorso-ventral.
Les divisions de segmentation conduisent au stade blastula (10 000 cellules). La fécondation a
déclenché une série d’événements moléculaires qui conduit certaines cellules à exprimer tel gène ou tel
groupe de gène à la suite de leur activation par les protéines issues de la traduction des ARNm
maternels. Parmi ces gènes, il y a ceux qui codent des protéines inductrices ou facteurs paracrines qui
sont sécrétés, ceux qui codent des récepteurs à ces facteurs et ceux qui produisent des facteurs de
transcription nécessaires aussi à l’expression des deux autres catégories. Ces molécules diffusibles, en
se fixant sur des cellules compétentes, déclenchent l’expression d’autres gènes qui codent à leur tour
ces mêmes catégories de molécules. Il s’agit d’induction en cascades. Un tissu est d’abord induit, puis
peut devenir à son tour inducteur. Les mouvements morphogénétiques du développement
embryonnaire mettent en contact des tissus précédemment séparés.
Au cours du stade blastula qui fait suite à la fécondation, trois séries d’événements moléculaires se
déroulent ;
– formation du centre de Nieuwkoop ;
– induction du centre organisateur de Spemann ;
– régionalisation du mésoderme : dorsal, latéral et ventral.
La rotation corticale entraîne une répartition de la β-caténine du côté dorsal ; des TGF-β (VegT, Vg1)
présents dans l’hémisphère végétatif sont activés après la fécondation ; ces TGF-β activent des gènes
dans des cellules situées dans l’hémisphère végétatif et notamment Xnr (Nodal). La zone dorso-
végétative où sont présents la β-caténine et les TGF-β constituent le centre de Nieuwkoop.
La β-caténine et les TGF-β déclenchent la transcription du gène siamois dans la région dorsale ; le
facteur de transcription siamois est à l’origine de la transcription d’autres gènes dans les cellules du
centre de Nieuwkoop dont des protéines inductrices du centre organisateur de Spemann.
Dans le centre organisateur, les gènes gooscoid et Xlim sont ainsi activés par siamois. Ces gènes
codent des facteurs de transcription qui organisent l’activité du centre de Spemann. Le centre de
Spemann émet dans la zone marginale, sous contrôle du facteur de transcription gooscoid, les facteurs
diffusibles Noggin, Chordin, Follistatin qui interviennent dans la régionalisation du mésoderme.
Par ailleurs, Vg1, VegT et la β-caténine induisent la production de Xnr (nodal) dans le centre de
Nieuwkoop . Il se forme alors un gradient de concentration dorso-ventral de Xnr qui part du centre de
Nieuwkoop. De fortes concentrations de nodal participent aussi à l’induction du centre organisateur de
Spemann.

3
De plus, des TGF-β (BMP4) et Wnt8 synthétisés à la suite de leur activation par des FGF présents dans
les macromères végétatifs diffusent dans la zone marginale. BMP4 et Wnt8 bloquent l’action de
molécules diffusibles (Noggin, Chordin, Follistatin) émises par le centre organisateur. Ces deux
gradients opposés sont à l’origine de la régionalisation du mésoderme.
Le centre organisateur de Spemann :
– devient le mésoderme cordal ;
– initie les mouvements de la gastrulation ;
– induit le mésoderme intermédiaire ;
– organise l’ectoderme en épiderme et neuroderme.
L’organisateur de Spemann réalise la régionalisation du mésoderme et la divergence de l’ectoderme en
utilisant les mêmes molécules. BMP4 diffuse également dans les cellules de l’ectoderme, mais du côté
dorsal ; les molécules émises par le centre organisateur s’opposent à leurs effets ventralisants.
L’ectoderme du côté dorsal devient neural alors que du côté ventral il devient de l’épiderme. D’autres
protéines de la région dorsale (Frizbee, Dickkopf) s’opposent à une autre voie ventralisante (Wnt8).
Ainsi, on distingue cinq types de signaux inducteurs à l’origine de la différenciation des trois feuillets :
– les signaux ventro-végétatifs qui spécifient le mésoderme ventral (Vg1 et Nodal à faibles
concentrations, FGF, activine) ;
– les signaux dorso-végétatifs issus du centre de Nieuwkoop qui spécifient le mésoderme dorsal et le
centre organisateur de Spemann (Nodal et Vg1 à concentrations élevées) ;
– des signaux ventraux qui ventralisent le mésoderme déjà induit (BMP4, Wnt8) ;
– des signaux dorso-ventraux issus du centre de Spemann (noggin, chordin, follistatin, frizbee) ;
– des signaux postéro-antérieurs responsables de la régionalisation de la corde et du système nerveux
(chordin, follistatin, noggin, cerberus, dickkopf, frizbee,) bloquant par inhibition compétitive les voies
ventralisantes BMP4 et Wnt8.
À partir du stade 32 cellules, les blastomères végétatifs induisent les cellules situées au-dessus d’elles
(cellules de la zone marginale) à donner du mésoderme. Un des premiers gènes à y être exprimés est le
gène brachyury (Xbra) codant un facteur de transcription qui active des gènes de ventralisation et
inhibe la transcription de gooscoid en dehors du centre de Spemann. Les cellules de Nieuwkoop
induisent donc le mésoderme dorsal et le centre de Spemann qui secrète, latéralement, à la fin de la
segmentation des signaux dorsalisants.
Les blastomères de la zone marginale ventrale (c’est-à-dire ceux opposés au centre de Spemann)
produisent des signaux ventralisant du mésoderme. La rencontre de ces deux gradients de molécules est
responsable de la spécification du mésoderme, elle constitue une information de position qui définit le
pattern d’expression des gènes. Durant la gastrulation, il y a poursuite des actions inductrices dorsales
et ventrales et les cellules du centre de Spemann conduisent l’ectoderme dorsal à devenir du tissu
neural. Les différents signaux émis par Spemann et la protéine cerberus participent à la régionalisation
du système nerveux dorsal.
À la fin de la neurulation, une régionalisation dorso-ventrale et une régionalisation antéro-postérieure
se construisent pour ce qui concerne le mésoderme axial et le tube nerveux. Les somites se fractionnent
en myotome à l’origine des muscles squelettiques, en dermatome à l’origine du derme et en sclérotome
à l’origine des vertèbres.
Chez les mammifères, la régionalisation poussée de la colonne vertébrale est due à l’expression des
gènes homéotiques. Ces 39 gènes regroupés en quatre complexes codent des facteurs de transcription à
homéodomaine qui se lient à l’ADN. Ces gènes s’expriment dans l’espace et dans le temps selon leur
ordre sur les chromosomes. La présence de telle ou telle combinaison de ces facteurs de transcription
définit une information de position qui engage les cellules dans une voie de développement donnée.
L’expression de ces gènes est sous la dépendance d’une substance qui reste à identifier, mais l’acide
rétinoïque montre cette capacité in vitro.
Les myoblastes expriment les gènes MyoD et Myf qui les engagent dans la voie de différenciation
musculaire, sans pour autant se différencier. Sous l’effet d’un FGF, ils se multiplient, puis s’alignent en
files parallèles sur la matrice extracellulaire. Ils fusionnent en myotubes qui synthétisent des protéines

4
musculaires à l’aide de facteurs de transcription du type MyoD ; ces protéines s’organisent
progressivement en sarcomères, puis en myofibrilles.
Les os se construisent à partir de cellules mésenchymateuses qui s’organisent et se transforment sous
l’effet de BMP en cellules cartilagineuses. Certaines se différencient en chondrocytes puis meurent
laissant des espaces qui fusionnent et donnent la cavité médullaire de l’os. Des ostéoblastes arrivés par
voie sanguine forment le tissu osseux compact. L’ossification se poursuit dans les épiphyses où le tissu
osseux spongieux remplace le cartilage à l’exception de la zone de transition entre la diaphyse et
l’épiphyse qui constitue le cartilage de conjugaison responsable de la croissance en longueur.
Les transformations morphologiques qui surviennent au cours de la métamorphose reposent sur des
mécanismes d’histolyses, d’histogenèse et de remaniements tissulaires. Ces changements sont
déclenchés par des doses croissantes de thyroxine qui modifient l’expression des gènes. Des
hydrolases, des phosphatases, des hyaluronidases diversifiées produites par les lysosomes sont
responsables de l’autolyse de certaines cellules dont les débris sont phagocytés et de la destruction de
la matrice extracellulaire. L’épithélium intestinal est remplacé par un épithélium secondaire qui sécrète
des enzymes adaptées à un régime carnivore (protéases, chitinases). Des gènes sont réprimés
(hémoglobine larvaire) alors que d’autres sont exprimés (hémoglobine adulte, enzymes du cycle de
l’urée, …). La métamorphose correspond à l’expression d’un second programme génétique qui adapte
l’animal à un milieu aérien et à un nouveau mode d’alimentation.

5
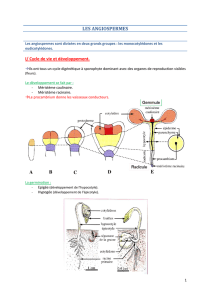
Résumé chapitre 32 : Organisation et fonctionnement des apex caulinaire et racinaire
La graine contient un embryon formé par une radicule, une gemmule et une tigelle portant
deux cotylédons protégé par des téguments. La germination débute avec la sortie de la
radicule par le micropile, son allongement, suivi par la sortie de la gemmule, la croissance de
la tigelle et la formation des feuilles.
L’extrémité de la racine présente un méristème apical dans lequel certaines cellules se
multiplient activement et génèrent des files de cellules qui s’allongent progressivement et se
différencient. Dans la gemmule, il existe aussi un méristème apical qui produit des files de
cellules. Les cellules méristématiques sont à l’origine des différents tissus de la plante, elles
se multiplient, certaines demeurent méristématiques alors que d’autres s’engagent dans une
voie de croissance et de différenciation.
Les cellules méristématiques sont isodiamétriques, possèdent un noyau relativement
volumineux, sphérique, riche en chromatine, situé au centre de la cellule, les organites y sont
peu différenciés.
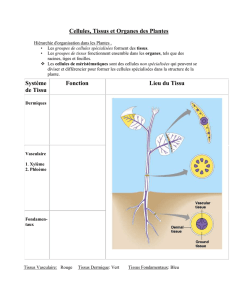
Les cellules des méristèmes primaires se différencient en cinq grands types de tissus
primaires : les tissus de revêtement, les parenchymes, les tissus conducteurs, les tissus de
soutien et les tissus de sécrétion.
Dans le méristème apical caulinaire, on distingue 3 couches de cellules appelées L1, L2, L3.
Les couches L1 et L2 à divisions anticlines forment la tunica qui recouvre un territoire plus
profond appelé corpus constitué par la couche L3. L1 constitue le protoderme, elle est à
l’origine de l’épiderme et du rhizoderme. L2 est à l’origine des parenchymes. L3 est à
l’origine des tissus conducteurs (procambium) et des parenchymes associés.
Selon la localisation, la taille et l’activité des cellules dans le méristème apical caulinaire, on
distingue la zone centrale (ZC) ou zone axiale (ZA), la zone périphérique (ZP) et la zone
médullaire (ZM). Ce sont les cellules de la zone périphérique qui se divisent activement.
Les cellules de la zone centrale fournissent des cellules qui renouvellent celles de la zone
centrale et de la zone médullaire. La zone périphérique assure la formation des primordiums
foliaires. La position de ces primordiums définie la position des feuilles sur la tige, c’est-à-
dire la phyllotaxie. Les cellules de la zone médullaire fournissent le parenchyme médullaire
et des cellules à l’origine des bourgeons axillaires.
La croissance en longueur de la tige passe par l’élongation des segments situés entre deux
primordiums foliaires. Ces segments constituent les entre-nœuds. Le procambium
appartenant à une ébauche foliaire se connecte aux tissus conducteurs des feuilles plus âgées
qui sont situés en position plus basse sur la tige. Le méristème primaire apical caulinaire
construit en même temps la tige et les feuilles, il est à la fois organogène et histogène.
Le développement et la croissance de la plante nécessitent le maintien du fonctionnement du
méristème apical caulinaire qui assure la conservation du nombre de cellules souches
nécessaire au maintien de sa taille et la construction de nouveaux organes conformément au
plan d’organisation de l’espèce.
Le contrôle du fonctionnement du méristème apical repose sur les interactions entre plusieurs
gènes dont les domaines d’expression sont connus.
L’expression du gène SHOOTMERISTEMLESS chez Arabidopsis maintient certaines cellules
dans un état indifférencié et empêche toute différenciation. Le produit de ce gène homéotique
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%