test psi

1
Épreuve de CHIMIE (Durée 2 heures)
L’usage d’une calculatrice est autorisé pour cette épreuve.
Si, au cours de l’épreuve, un candidat repère ce qui lui semble être une erreur d’énoncé, il le signale sur sa
copie et poursuit sa composition en expliquant les raisons des initiatives qu’il a été amené à prendre.
* Quelques données thermodynamiques à 298 K :
)10ln(
FT.R
= 0,06 V ; R = 8,314 J.K-1.mol-1
fH° : Enthalpie standard de formation
S° : Entropie standard
Cp° : Capacité calorifique à P constante
* Potentiels standard d'oxydoréduction à pH = 0 et 298 K :
Couple Ox/Red
O2(g)/H2O
H2O/H2(g)
Zn2+/Zn(s)
Al3+/Al(s)
E° en V
1,23
0,00
-0,76
- 1,66
* Quelques constantes thermodynamiques à 298 K.
Al(OH)3(s) = Al3+ + 3 HO- pKs = 32,0 Ks : Produit de solubilité
Al3+ + 4 HO- = [Al(OH)4]- log 4 = 34,0 4 : Constante globale de formation
I- ÉTUDE DE LA SYNTHÈSE DE L'AMMONIAC.
La synthèse de l'ammoniac consiste à faire réagir du diazote et du dihydrogène selon l'équilibre
chimique d'équation : N2(g) + 3 H2(g) = 2 NH3(g)
I-1. Pourquoi l’enthalpie standard de formation fH° de dihydrogène est nulle?
I-2. Donner la variance du système en équilibre et en donner la signification si :
I-2.1. On introduit les réactifs dans des proportions quelconques.
I-2.2. On introduit les réactifs dans les proportions stoechiométriques.
I-3. En vous servant des données thermodynamiques de début d’énoncé,
I-3.1. Déterminer la valeur de l'enthalpie standard de réaction rH°(298K) de cette réaction.
I-3.2. Déterminer la valeur de l'entropie standard de réaction rS°(298K) de cette réaction.
Justifier simplement le signe de rS°(298K).
I-3.3. Déterminer les valeurs de l'enthalpie standard de réaction et de l'entropie standard de
réaction à la température de 450 °C. Comparer les valeurs obtenues à celles calculées à la
température de 25 °C. L'approximation d'Ellingham peut-elle être appliquée ?
I-3.4. En appliquant l'approximation d'Ellingham, donner l'expression de l'enthalpie libre de
réaction rG°(T) en fonction de la température T.( on prendra rH°(298K) et rS°(298K)).
I-3.5. Par définition, la température d'inversion d'un équilibre chimique est la température Ti
pour laquelle l'enthalpie libre standard de la réaction est nulle : rG°(Ti) = 0
Déterminer la valeur de la température d'inversion Ti de cet équilibre. Quelle est la valeur de la
constante d'équilibre K°(Ti) pour T = Ti ?
H2(g)
N2(g)
NH3(g)
fH° (kJ.mol-1)
0
0
- 46,11
S° (J.K-1.mol-1)
130,68
191,61
192,45
Cp°(J.K-1 .mol-1)
28,82
29,12
35,06

2
I-3.6. Quelle est l'influence d'une élévation de température sur cet équilibre ? Déterminer la
valeur de la constante d'équilibre à 25 °C et à 450 °C ? A quelle température doit-on réaliser la
synthèse de l'ammoniac ?
I-3.7. En réalité, cette synthèse est réalisée à une température de l'ordre de 450 °C. Donner la
raison de ce choix. Quelle autre méthode évite pour cette synthèse l'utilisation d'une température
encore plus élevée ?
I-4. Quelle est l'influence d'une augmentation de la pression totale p sur l'évolution de cet équilibre ?
Cette synthèse doit-elle être réalisée à faible ou à haute pression ?
I-5. On considère un mélange composé d'une mole de dihydrogène et de n moles de diazote, T et p
étant fixées.
I-5.1. Faire un tableau bilan de matière en exprimant les quantités de matière des espèces
présentes à l'équilibre en fonction de l’avancement .
I-5.2. Exprimer la fraction molaire d'ammoniac x(NH3) en fonction de n et .
I-5.3. Montrer que la fraction molaire x(NH3) est maximale lorsque n = 1/3. Quel type de
mélange doit-on réaliser pour satisfaire à cette condition sur la valeur de n ?
I-5.4. Une étude, non abordée ici, montre que l'avancement est maximal à l'équilibre
lorsque n = 1 mole.
Donner les expressions de x(NH3)max pour n = 1/3 en fonction de et de x(NH3) pour n = 1 en
fonction de max.
Quel est l'effet d'un excès de diazote sur la valeur de x(NH3).
I-6. On considère maintenant la synthèse de l'ammoniac à une température de 450 °C, sous une
pression de 200 bar, à partir d'un mélange en proportions stœchiométriques en diazote et en
dihydrogène.
I-6.1. Exprimer la constante d'équilibre à partir des pressions partielles des différents
constituants présents à l'équilibre.
I-6.2. Montrer que l’expression de la constante d'équilibre en fonction de = /n, taux de
transformation de cette synthèse s’écrit :
4
22
2)1.(27 )2.(.16
P
1
K
I-6.3. Déterminer la valeur de et la valeur de la fraction molaire maximale en ammoniac.
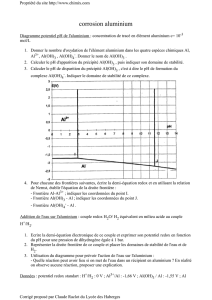
II- Diagramme E-pH de l’aluminium : stabilité de Al dans l’eau.
II-1. Diagramme E-pH de l’aluminium
II-1.1. Donner la configuration électronique de l'élément Al de numéro atomique Z = 13.
Pourquoi l'aluminium existe-t-il essentiellement au degré d'oxydation (+III) ?
II-1.2. L'élément Al au degré d'oxydation (+III) peut exister sous les formes Al3+, Al(OH)3(s)
et Al(OH)4-. Comment qualifie-t-on l'hydroxyde l'aluminium ? Donner le nom de l'ion complexe
Al(OH)4-.

3
II-1.3. Indiquer sur le diagramme potentiel-pH de l'aluminium, donné en annexe (figure 2),
les espèces qui prédominent dans les domaines 1, 2, 3 et 4. Ce diagramme a été tracé pour une
concentration globale d'aluminium dissous égale à 10-2 mol.L-1.
II-1.4. Déterminer les valeurs pH1 et pH2 du pH telles que respectivement :
- le précipité d'hydroxyde d'aluminium apparaisse,
- le précipité d'hydroxyde d'aluminium disparaisse.
II-1.5. Par définition la solubilité s de l'hydroxyde d'aluminium est s = [Al3+] + [Al(OH)4-]
tenant compte de toutes les espèces en solution contenant de l'aluminium.
Montrer que l’expression de la solubilité s de Al(OH)3 en fonction de [H3O+] = h dans le domaine
[pH1, pH2] sera :
h
K
K
KhK
sE
S
E
S..
.4
3
3
II-1.6. Déterminer la valeur du pH lorsque la solubilité est minimale, et la valeur de la
solubilité correspondante.
II-1.7. Établir les équations des segments de droite AB, BC et CD du diagramme potentiel-
pH de l'aluminium.
II-1.8. Le métal Al est-il plus ou moins réducteur en milieu acide ou en milieu basique ?
II-2. Diagramme E-pH de l’eau :
II-2.1. La frontière O2(gaz)/H2O :
a- Écrire la demi-équation électronique relative au couple O2 (g) / H2O (liq) ainsi que la
formule de Nernst associée. En supposant la pression partielle des espèces gazeuses à
la frontière égale à 1 bar, donner l’équation de la frontière relative.
b- Tracer sur la figure 2 (document-réponse) la frontière O2(gaz)/H2O
II-2.2. La frontière H+/H2(g):
a- Écrire la demi-équation électronique relative au couple H+/H2(g) ainsi que la formule de
Nernst associée. En supposant la pression partielle des espèces gazeuses à la frontière
égale à 1 bar, donner l’équation de la frontière relative à ce couple.
b- Tracer sur la figure 2 (document-réponse) la frontière H+/H2(g) .
II-2.3. Compléter alors la figure 2 et y faire figurer les domaines de stabilité de O2 (g) , H2 (g) et de
H2O.
II-2.4. Écrire les réactions entre le solvant H2O et l’aluminium pour les 3 domaines du pH.
II-2.5. Indiquer les domaines de corrosion, immunité et passivité du métal aluminium.
III- Électrolyse de la solution de sulfate de zinc acidifiée
Pour obtenir le zinc sous forme métallique, on procède à l’électrolyse d’une une solution de sulfate
de zinc à 2 mol.L-1 que l’on acidifie par de l’acide sulfurique à 1,5 mol.L-1. Le pH de la solution sera
considéré égal à 0.
Les électrodes utilisées sont : cathodes en aluminium et anodes en plomb inattaquables en milieu
sulfate. Les cuves sont en ciment revêtues de polychlorure de vinyle (PVC).
1. Nous considérerons dans la suite que les ions sulfates ne participent à aucune réaction.
D’un point de vue thermodynamique.

4
a- Quelles sont les réactions qui peuvent avoir lieu à la cathode ? à l’anode ?
b- Calculer le potentiel E pour chaque couple mis en jeu.
c- En déduire la réaction d’électrolyse attendue. Quelle différence de potentiel devrait-
on appliquer ?
2. A l’aide la figure 1 donner l’équation d’électrolyse qui a réellement lieu. A quoi sont dus
ces changements ? Si on impose une densité de courant de 500 A.m-2, quelle devrait être la
différence de potentiel appliquée aux bornes des électrodes ?
3. La différence de potentiel est en réalité de 3,5 V. Expliquer la différence par rapport à la
valeur estimée à la question précédente.
IV- UTILISATIONS DU ZINC
A) On réalise les expériences suivantes :
Un clou (assimilé à du fer) est plongé dans une solution aqueuse gélifiée contenant du chlorure de
sodium, de la phénolphtaléine (indicateur incolore qui devient rose en présence d’ions HO- ) et de
l’hexacyanoferrate (III) de potassium (indicateur incolore qui devient bleu en présence d’ions Fe2+).
On observe une coloration bleue autour de la tête et la pointe et une coloration rose autour de la
partie centrale du clou.
On refait la même expérience en enroulant un ruban de zinc autour de la partie centrale du clou. Il
n’y a pas de coloration bleue mais un voile blanchâtre autour du zinc.
4. Dans quels cas des zones différentes d’une même pièce métallique peuvent-elles avoir un
comportement électrochimique différent ?
5. Expliquer le phénomène observé dans la première expérience en écrivant les différentes réactions
qui ont lieu dans la solution.
6. Que se passe-t-il dans la deuxième expérience ? En déduire une utilisation du zinc dans la vie
courante.
Fin du texte

5
Nom et prénom : ……………………………………… … ….
ANNEXE (document-réponse) à rendre avec la copie
Figure 2 : Diagramme potentiel-pH de l'aluminium
Pour une concentration totale en aluminium dissous égale à 10-2 mol.L-1
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%