Lire l'article complet

Dossier
thématique
Les anévrismes de l’aorte
abdominale (AAA)
Coordonné par Pierre Julia
(Service de médecine vasculaire
hôpital Georges-Pompidou, Paris)
I
Scanner d’AAA montrant le thrombus endoanévrysmal.

II
Épidémiologie
Il semble exister une aug-
mentation de fréquence des
AAA dans la population des
pays industrialisés et en par-
ticulier dans la population
âgée. Les chiffres de décès
liés à un AAA sont en aug-
mentation dans de nombreux
pays, en particulier aux
États-Unis, mais aussi en
Grande-Bretagne, au Dane-
mark et en Australie. Dans
une étude de la Mayo Clinic,
il est fait état d’une augmen-
tation d’un facteur 7 de l’in-
cidence des AAA, passant
de 4,7 pour 100 000 dans les
années 1950, à 32 pour
100 000 à la fin des années
1970. Le sex-ratio est
variable de 3 à 8 hommes
pour une femme, mais la
prédominance masculine est
une constante remarquable
de toutes les études. L’âge
est aussi un facteur influen-
çant notablement l’incidence
des AAA : de 83 pour
100 000 chez l’homme de
50 à 60 ans, celle-ci atteint
500 pour 100 000 chez
l’homme de plus de 80 ans.
Le sex-ratio diminue avec
l’âge, mais la prédominance
masculine reste significative.
Il existe également une pré-
valence plus importante des
AAA chez les sujets de race
blanche comparés aux sujets
de race noire, cette différence
étant surtout nette chez les
sujets de sexe masculin.
L’augmentation de la fré-
quence observée des AAA
pourrait être due en partie à
l’amélioration des outils
diagnostiques et en particu-
lier l’échographie-Doppler,
cela étant particulièrement
vrai pour les petits ané-
vrismes asymptomatiques
non compliqués. Il semble
cependant que la prévalence
des anévrismes plus volumi-
neux et compliqués soit, elle
aussi, en augmentation, puis-
que la mortalité standardi-
sée, liée à un AAA, a aug-
menté de façon majeure
entre les années 1950 et les
années 1980. Tout cela pou-
vant faire conclure à une
augmentation vraie de l’in-
cidence des AAA.
Au cours de ces dernières
années, de nombreuses étu-
des de dépistage ont été
publiées, qui ont permis de
mieux évaluer l’incidence
épidémiologique des AAA.
Ces études reposent princi-
palement sur l’échographie-
Doppler. Elles ont surtout
permis de mettre en évidence
des différences notables en
rapport avec le diamètre
anévrismal. En effet, chez les
hommes de 60 à 70 ans, on
retrouve un très petit AAA
(2,5 à 3 cm) chez 5 à 9 % de
la population. Un anévrisme
clinique de 5 cm de diamè-
tre et plus n’est retrouvé que
dans 0,5 à 1,5 % de la popu-
lation. Les petits anévrismes
(3,5 à 4 cm) sont retrouvés
dans 1,5 à 4 % de cette
population. De plus, une
étude anglaise récente a
montré le bénéfice d’une
mesure unique du diamètre
de l’aorte abdominale à
l’âge de 65 ans. En utilisant
comme valeur seuil 3 cm de
diamètre, cette étude a mon-
tré que cette mesure unique
permettait d’évaluer les pa-
tients qui seront à risque
dans les dix ans à venir et
qui doivent bénéficier de
contrôles par échographie-
doppler régulièrement. Une
étude danoise a montré, sur
plus de 12 000 patients, le
bénéfice du dépistage systé-
matique des AAA dans une
population d’hommes âgés
de 65 à 73 ans. Le dépistage
semble efficace en permet-
tant une réduction de la
Les anévrismes de l’aorte abdominale
(AAA)
Pierre Julia*
Le Courrier de Médecine Vasculaire (2), n° 3, juillet/août/septembre 2002
* Service de médecine vascu-
laire, hôpital Georges-Pompidou,
Paris.
Dossier thématique
L
’anévrisme aortique se définit comme une dilatation
aortique avec perte du parallélisme des bords et aug-
mentation du diamètre aortique de plus de 50 % par rapport
au diamètre de l’aorte saine en amont de cette dilatation. Sa
prévalence dans la population générale a augmenté ces der-
nières années, au moins partiellement du fait, d’une pratique
plus répandue du dépistage systématique en particulier par
échographie-doppler. La plupart des anévrismes de l’aorte
abdominale (AAA) sont totalement asymptomatiques et leur
histoire naturelle est restée un sujet de controverse en parti-
culier en ce qui concerne leur risque de rupture qui était
estimé de façon globale à environ 6 % par an, mais qui
dépend essentiellement de leur diamètre maximal. La chi-
rurgie conventionnelle est représentée essentiellement par
la mise à plat-greffe effectuée selon des modalités
variables. Le traitement endovasculaire développé depuis
1991 repose sur l’utilisation d’ endoprothèses aortiques qui
ont démontré leur faisabilité, mais dont le bénéfice réel
pour le patient demande encore à être précisé. Enfin le
traitement des anévrismes rompus reste décevant, la
chirurgie conventionnelle fait état de quelques progrès,
mais avec une mortalité encore très élevée, le traitement
endovasculaire en est encore à ses débuts, mais les
premières expériences font penser qu’il pourrait s’agir de
la méthode de choix quand elle est réalisable.

Dossier thématique
III
mortalité hospitalière des
AAA et apparaît comme un
moyen rentable de réduire
les coûts liés à cette mortalité.
Des résultats comparables
ont été publiés récemment
au Royaume-Uni sur une
population plus réduite
(6 058 patients). Un point
important souligné dans
cette dernière étude était le
fait que le bénéfice du
dépistage était largement
dépendant de la compliance
des patients aux examens
avec près de 80 % des décès
du groupe contrôle attri-
buables au refus des patients
de passer la première écho-
graphie ou à leur inobser-
vance du suivi du protocole.
D’autres études ont souligné
l’intérêt de dépister les
patients de sexe masculin,
jumeaux d’un patient porteur
d’un AAA. En revanche, le
dépistage systématique des
AAA dans la population
féminine ne semble rentable
ni cliniquement ni économi-
quement.
Les facteurs de risque des
AAA ont longtemps été
source de controverses mul-
tiples. L’étude ADAM (Aneu-
rysm Detection and Mana-
gement) a permis de mieux
les préciser : parmi eux, le
tabagisme est le plus forte-
ment corrélé à un AAA de
plus de 40 mm de diamètre.
L’association entre AAA et
tabagisme croît avec le
nombre d’années d’intoxi-
cation. À l’opposé, le sexe
féminin, la race noire et la
présence d’un diabète sont
corrélés négativement avec
la présence d’un AAA. Les
facteurs familiaux sont for-
tement influents mais étaient
présents chez seulement 5 %
des participants ; ils ont donc
une influence individuelle
forte, mais une influence
réduite à l’échelle d’une
population. D’autres fac-
teurs, tels l’âge, la présence
d’une atteinte coronarienne,
d’une atteinte athéromateuse
de n’importe quel territoire,
d’une hypercholestérolémie
et d’une hypertension ont
été corrélés positivement
avec la présence d’un AAA,
mais de façon moins impor-
tante.
Quoi qu’il en soit, tous les
anévrismes dépistés ne doi-
vent pas systématiquement
être traités rapidement. En
effet, en dehors des compli-
cations évolutives, telles un
syndrome de compression
de voisinage ou des acci-
dents emboliques, la princi-
pale complication est la rup-
ture, et celle-ci survient
dans un délai très variable
en fonction de la taille ané-
vrismale. Le risque de rup-
ture a été évalué en fonction
de la taille depuis plusieurs
années : faible pour les AAA
inférieurs à 5 cm, atteignant
9 et 12,5 % par an respecti-
vement sur des modélisa-
tions pour des diamètres res-
pectifs de 6,5 et 7,5 cm. Les
études récentes sur les petits
anévrismes effectuées au
Royaume-Uni et dans les
Veterans Hospitals aux États-
Unis ont permis d’affiner
singulièrement ces modèles.
En effet, dans ces études, le
risque annuel de rupture des
AAA inférieurs à 5,5 cm de
diamètre était de l’ordre de
1%. À l’inverse, le suivi de
patients inopérables ou ayant
refusé l’intervention, récem-
ment rapporté par l’équipe
des “Veterans”, conclut de
façon formelle à un risque
de rupture évoluant expo-
nentiellement avec le dia-
mètre : 9,4 % par an pour
des diamètres compris entre
5,5 et 5,9 cm, 19 % par an
pour des diamètres compris
entre 6,5 et 6,9 cm et 32 %
par an si le diamètre est
supérieur ou égal à 7 cm.
L’étude anglaise sur les
petits anévrismes publiée en
1998 dans le Lancet a porté
sur plus de 1 000 patients
randomisés entre 1991 et
1995. Avec un suivi de plus
de 4 ans et une mortalité
opératoire de 5,8 %, cette
étude n’a pas mis en évidence
de différence de mortalité
entre le groupe des opérés et
le groupe suivi par échogra-
phie à tous les intervalles de
temps considérés. La conclu-
sion de cette étude fut l’ab-
sence de bénéfice apporté
par une chirurgie précoce
pour le groupe des ané-
vrismes compris entre 4 et
5,5 cm de diamètre. À noter
que parallèlement les auteurs
ont suivi des patients por-
teurs d’anévrismes plus larges
et n’ayant pas été opérés : leur
conclusion est clairement en
faveur d’une augmentation
considérable du risque de rup-
ture lorsque le diamètre ané-
vrismal dépasse 6 cm.
Au mois de mai 2002 sont
parus dans le même numéro
du New England Journal of
Medicine deux articles com-
plémentaires sur le même
thème. Le premier rapporte
les résultats de l’étude ADAM

Le Courrier de Médecine Vasculaire (2), n° 3, juillet/août/septembre 2002
IV
sur la survie relati-
ve de deux groupes
de patients opérés
précocement ou
surveillés tous les
six mois par écho-
graphie-Doppler. Malgré une
mortalité opératoire faible de
2,7 %, aucun bénéfice en
termes de survie ne fut mis en
évidence dans le groupe
opéré par rapport au groupe
surveillé. Ces résultats étant
remarquablement parallèles à
ceux de l’étude anglaise de
1998. Le deuxième article
rapporte les résultats à long
terme de cette même étude
anglaise avec un suivi de huit
ans. La stabilité des résultats
obtenus est remarquable avec
encore une fois une survie
moyenne comparable dans les
deux groupes. Il faut noter
cependant que la mortalité
globale à huit ans fut inférieu-
re dans le groupe des opérés,
et qu’une des raisons pos-
sibles pour expliquer cette
différence était un meilleur
contrôle des facteurs de
risque et en particulier l’arrêt
de l’intoxication tabagique
dans le groupe des patients
opérés précocement.
Au total, ces études montrent
que la surveillance des ané-
vrismes inférieurs à 5,5 cm de
diamètre est une attitude four-
nissant des résultats équiva-
lents de ceux de la chirurgie
précoce à condition d’assurer
un suivi parfait des patients
par échographie-Doppler bi-
annuelle. La cure chirurgicale
peut cependant être proposée
en particulier chez les fem-
mes ou chez les patients dési-
rant fortement se faire opérer
et sous couvert d’une excel-
lente espérance de vie. Les
équipes chirurgicales doivent
avoir des résultats plus que
corrects avec, en particulier,
une mortalité nettement infé-
rieure à 5 %. Une remar-que
cependant est la forte propor-
tion des patients qui, avec le
temps, rejoignent le groupe
chirurgical (80 % si le dia-
mètre initial de l’anévrisme
était compris entre 5 et
5,5 cm). Ce fait traduit sim-
plement l’évolution naturelle
des AAA. Les indications
opératoires de la majorité des
équipes chirurgicales ne vont
pas être radicalement modi-
fiées par ces résultats : en effet,
aujourd’hui, nous opérons les
patients pour des anévrismes
de diamètre égal à 5 cm ou
plus. La grande majorité de
ces anévrismes atteindront la
valeur fatidique de 5,5 cm au
cours de l’année suivante ; il
semble donc licite de propo-
ser à ces patients un traite-
ment chirurgical relativement
rapide.
Circonstances
de découverte
des anévrismes
Il peut s’agir de complications
plus ou moins bruyantes :
embolie artérielle, compres-
sion urétérale, syndrome
douloureux abdominal, dys-
phagie. Rarement, c’est la
palpation d’une masse bat-
tante abdominale par le
patient lui-même ou un pra-
ticien. Le plus souvent
actuellement, les AAA sont
découverts fortuitement lors
d’examens pratiqués pour
d’autres causes. Il peut s’agir
de causes cardiovasculaires :
échographie-Doppler aor-
tique demandée pour le
bilan d’une autre atteinte
athéromateuse coronarienne
ou carotidienne. Il s’agit
également souvent d’une
échographie abdominale ou
prostatique pour des patho-
logies abdominales ou uro-
logiques ; ou d’un scanner
du rachis lombaire lors d’un
bilan pour lombalgies. En
fonction de la taille du dia-
mètre maximal mesuré lors
de ce premier examen mor-
phologique, l’une des deux
attitudes suivantes est adop-
tée : surveillance échogra-
phique régulière ou bilan
préopératoire rapide.
Bilan préopératoire
d’un anévrisme
de l’aorte abdominale
Lorsque la décision d’inter-
venir a été prise, un double
bilan est nécessaire : général
du patient et morphologique
de l’anévrisme.
Le bilan général doit com-
porter l’étude des autres terri-
toires artériels touchés poten-
tiellement par l’athérome :
essentiellement les coronaires
et les troncs supra-aortiques.
En ce qui concerne les coro-
naires, il n’y a pas de consen-
sus général sur les examens
nécessaires en préopératoire.
Chez les patients symptoma-
tiques cliniquement ou avec
des signes électrocardiogra-
phiques d’atteinte coronaire,
la coronarographie sera systé-
matique. Chez les patients
asymptomatiques, certaines
équipes, comme la nôtre,
sont favorables à la corona-
Dossier thématique
Artériographie de l’aorte abdomi-
nale anévrysmale.

Dossier thématique
V
rographie systématique, dou-
blée dans les cas difficiles
d’une épreuve d’ischémie
myocardique type scintigra-
phie ou plutôt actuellement
échographie-dobutamine.
Pour d’autres, ce sont les
épreuves d’ischémie myo-
cardique qui sont faites en
première intention et la
coronarographie n’est prati-
quée qu’après les résultats
positifs de la première
épreuve. Le but de ce dépis-
tage de lésions corona-
riennes n’est pas tant une
réduction du risque péri-
opératoire d’événements
myocardiques qu’une amé-
lioration de la survie à
moyen et long termes de ces
patients. En effet, l’étude de
la survie des patients opérés
d’AAA montre que les évé-
nements cardiaques sont
responsables de plus du tiers
des décès lors du suivi. En
ce qui concerne les troncs
supra-aortiques, la pratique
d’une échographie-Doppler
est systématique en préopé-
ratoire afin de dépister une
sténose carotidienne interne
serrée (supérieure à 70 %),
dont la cure chirurgicale
pourra être nécessaire soit
avant, soit pendant le geste
sur l’anévrisme.
Parmi les autres examens
complémentaires nécessaires,
les épreuves fonctionnelles
respiratoires sont essentielles
et devront conduire à faire
pratiquer des séances de
kinésithérapie respiratoire
préopératoires. L’utilité de
celles-ci a été démontrée
avec pour conséquence prin-
cipale une réduction du
temps d’intubation postopé-
ratoire des patients insuffi-
sants respiratoires.
Un bilan biologique standard
aura surtout pour but de
dépister une insuffisance
rénale préopératoire pouvant
limiter les examens complé-
mentaires iodés, et dont on
sait qu’elle est un facteur
aggravant du pronostic.
Le bilan morphologique de
l’anévrisme repose sur l’écho-
graphie initialement, mais la
référence actuelle est la tomo-
densitométrie. Les scanners
multibarettes actuels per-
mettent l’acquisition de très
nombreuses images en des
temps très courts et d’effec-
tuer des reconstructions
très précises. Ils nécessitent
cependant une irradiation et
l’injection de produit de
contraste iodé. L’angio-IRM
est en cours d’évaluation
pour les bilans d’anévrismes ;
elle ne nécessite pas de pro-
duits iodés et n’entraîne pas
d’irradiation, mais elle est
très peu performante sur les
calcifications et n’est pas
aussi disponible que les
scanners. L’artériographie
est aujourd’hui de moins en
moins utilisée ; elle permet
cependant de visualiser par-
faitement les artères rénales,
les artères digestives, les
lombaires et les iliaques. De
plus, actuellement, elle est
l’examen le plus fiable pour
effectuer les mesures précises
de longueur des collets et des
segments artériels néces-
saires quand on évoque la
possibilité de traitement
endovasculaire par mise en
place d’une endoprothèse
aortique.
C’est dans ces cas que le
bilan morphologique doit
être le plus précis, et parmi
les critères nécessaires, on
retiendra surtout l’existence
d’un collet sous-rénal d’au
moins 15 mm de long, fai-
sant un angle de moins de
40 ° avec l’axe aortique, peu
calcifié, et ne contenant pas
de thrombus. Le deuxième
critère incontournable, avec
les endoprothèses commer-
cialisées actuellement, est
l’existence d’artères iliaques
larges avec tortuosités et
calcifications réduites. Le
bilan morphologique avant
chirurgie conventionnelle
peut être plus limité et réduit
à un scanner ou à une IRM
seule. Les points importants
à connaître en préopératoire
sont le nombre et la topogra-
phie des vaisseaux rénaux,
l’existence éventuelle d’ano-
malies veineuses rénales ou
caves et l’état des artères
iliaques pour prévoir à
l’avance le geste probable qui
sera réalisé.
La mise à plat-greffe
C’est le traitement classique
réalisé initialement par voie
xypho-pubienne et actuelle-
ment de plus en plus par
voie mini-invasive, voire
totalement laparoscopique.
Après contrôle et clampage
de l’aorte sous-rénale et des
artères iliaques, l’anévrisme
est ouvert longitudinalement
et les caillots sont évacués.
Les reflux sanguins prove-
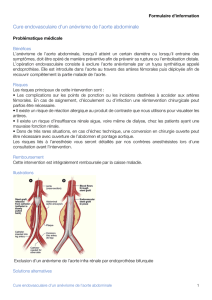
Le traitement des anévrismes de l’aorte abdominal est
aujourd’hui partagé entre la mise à plat-greffe chirurgicale et
le traitement endovasculaire par mise en place d’endo-
prothèses réalisant l’exclusion du sac anévrismal.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%