A Immunothérapie ACTUALITÉS ASCO 2008

La Lettre du Cancérologue • Supplément 5 au n° 7 - Vol. XVII - septembre 2008 | 17
ACTUALITÉS
ASCO 2008
Immunothérapie
J.P. Madiou*
A
u cours de cet ASCO 2008, plusieurs commu-
nications orales et des posters ont traité
de l’intérêt de l’immunothérapie. Dans le
traitement des mélanomes, les résultats obtenus
dans les études de phase II/ III avec l’ipilimumab et
le trémélimumab – Ac anti-CTLA-4 visant à stimuler
l’immunité des patients – se révèlent globalement
décevants, même si une étude associant trémé-
limumab et IFNα-2b à forte dose se poursuit.
Concernant le glioblastome, l’étude de phase II
ACT II montre des résultats très prometteurs avec
le CDX-110, vaccin ciblant la variante III d’EGFR,
administré en association avec le témozolomide : la
survie médiane est de 33,1 mois (versus 15,2 mois
pour le témozolomide seul ; p = 0,0078) et la SSP de
16,6 mois (versus 6,4 mois pour le bras contrôle).
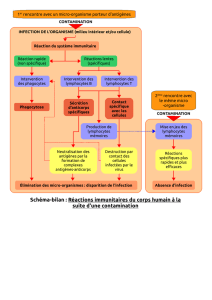
Immunothérapie active :
stimuler l’immunité des patients
par des anticorps anti-CTLA-4
Principe des vaccins
dirigés contre les antigènes tumoraux,
reconnaissance et activation
du lymphocyte T par une cellule
présentatrice d’antigène
et déclenchement d’une réponse
immunitaire antitumorale “idéale”
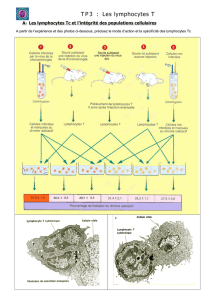
L’antigène présenté par les molécules du complexe
majeur d’histocompatibilité (CMH), de classe II ou I,
est reconnu par des lymphocytes T, CD4 (auxiliaire)
ou CD8 (cytotoxique), respectivement spécifiques de
cet antigène. Les lymphocytes ne sont activés que
si le signal de reconnaissance spécifique du peptide
est accompagné des signaux dits de costimulation.
Le second signal est délivré au lymphocyte T lors
de l’interaction de récepteurs accessoires avec des
ligands situés à la surface des cellules présentatrices
d’antigènes (CPA). Les molécules B7 jouent ce rôle
par leur liaison aux récepteurs CD28. En l’absence de
ce deuxième signal, le lymphocyte devient tolérant à
l’antigène. Les cellules dendritiques sont les CPA les
plus efficaces pour engendrer des effecteurs cyto-
toxiques spécifiques des cellules tumorales, alors que
c’est dans les aires T d’un ganglion de drainage que se
met en place la réponse cellulaire T. Le niveau d’ex-
pression des molécules de costimulation est corrélé
à l’état de maturation des cellules dendritiques. Les
lymphocytes T CD4 ainsi activés sécrètent des cyto-
kines pro-inflammatoires, en particulier l’IL-2 néces-
saire à leur prolifération, et favorisent également la
maturation des CPA par l’engagement du CD40L.
Dans ces conditions, les cellules dendritiques devien-
nent capables d’activer directement des lymphocytes
T CD8 naïfs. Ce sont les seules CPA douées de cette
capacité, et cela grâce à leur niveau d’expression
des molécules de costimulation et de présentation.
Cette activation directe permet d’engendrer une
réponse cellulaire cytotoxique protectrice. La lyse de
la cellule cible se réalise alors par un mécanisme de
cytotoxicité dépendante de la perforine et des gran-
zymes ou par un mécanisme d’induction d’apoptose
par la fixation de la lymphotoxine ou du ligand de
Fas des lymphocytes T CD8 sur, respectivement, le
récepteur du TNF ou Apo1/ Fas.
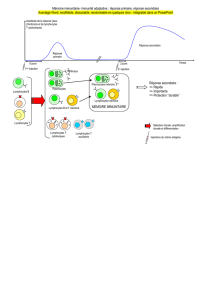
Mécanisme d’action
des anti-CTLA-4
La molécule CTLA-4 est un récepteur lymphocy-
taire dont la fonction à l’état normal est de freiner
l’activation des lymphocytes T après présentation
d’un antigène par les CPA. Le récepteur CTLA-4 est
lié aux molécules B7 avec une plus grande affinité
que le récepteur CD28 et envoie un signal négatif
aux lymphocytes T. L’inhibition de CTLA-4 par un
Ac anti-CTLA-4 permet de prévenir l’interaction
avec les molécules B7 et de lever ainsi ce frein de
l’activation des lymphocytes T (figure).* Paris.

Figure. Mécanisme d’action des anti-CTLA-4. L’anticorps anti-CTLA-4 permet de prévenir
l’interaction avec les molécules B7 et de lever le frein de l’activation des lymphocytes T.
TCR
CMH Antigène
B7 CD28
CTLA4
Lymphocyte TCellule dendritique
18 | La Lettre du Cancérologue • Supplément 5 au n° 7 - Vol. XVII - septembre 2008
Immunothérapie
ACTUALITÉS
ASCO 2008
Principaux résultats de la classe
à l’ASCO 2008
Au cours d’une session consacrée aux nouvelles
approches thérapeutiques dans le traitement du
mélanome, deux communications (1, 2) ont traité
de l’immunothérapie visant à stimuler l’immunité des
patients par des Ac anti-CTLA-4. Malgré des taux de
RO décevants (de l’ordre de 10 %) dans les mélanomes
de stade III/ IV, des études réalisées avec l’ipilimumab
(10 mg/ kg toutes les 3 semaines en traitement d’in-
duction sur 4 mois) montrent, pour certains patients,
une tendance à l’amélioration de la survie, et ce même
chez les patients considérés comme non répondeurs
(1), avec 30 % des patients (n = 7, dont 1 RC et 1 RP)
toujours en vie au terme des 2 ans de suivi et des
réponses qualifiées d’“ originales” (2) [réponse retardée
malgré l’apparition de nouvelles lésions chez 53 des
155 patients inclus mais qui diminueront par la suite].
Ces résultats, même s’ils sont à pondérer compte
tenu du faible nombre de patients inclus, doivent sans
doute faire réfléchir à la pertinence des critères d’éva-
luation utilisés dans les études, puisque l’apparition
de nouvelles lésions ne semble pas obligatoirement
signifier l’échec du traitement. Plusieurs hypothèses
peuvent être envisagées : l’action est retardée du fait du
mode d’action indirect, ou il y a une fausse augmenta-
tion du fait d’une activation du système immunitaire,
avec recrutement de lymphocytes.
Évaluant cette fois-ci l’intérêt d’une vaccination
par un ganglioside, l’essai EORTC 18961 (3) est le
plus grand essai en adjuvant jamais réalisé dans le
mélanome. Au total, 1 314 patients atteints d’un
mélanome de stade II épais (supérieur à 1,5 mm)
à haut risque de récidive ont été randomisés en
deux bras : vaccination par un ganglioside (GM2-
KLH21) ou simple surveillance. Avec un suivi moyen
de 1,8 an, la deuxième analyse intermédiaire prévue
au protocole n’a montré aucune différence sur le
critère principal (survie sans récidive [SSR]), ce qui
a entraîné l’arrêt de l’étude, alors que la survie sans
métastases et la SG ont diminué (respectivement,
p = 0,08 et p = 0,03) dans le bras vaccination.
Anti-CTLA-4
(CP675, 206 - trémélimumab)
et CDX 110 : principaux résultats
cliniques présentés à l’ASCO
Traitement du mélanome
Plusieurs études ont été présentées dans une session
consacrée au traitement du mélanome au stade
métastatique.
Une étude de phase III (4) comparant le tréméli-
mumab (15 mg/ kg tous les 3 mois) à la dacarbazine
(1 000 mg/ m2 tous les 21 jours) ou au témozolomide
(200 mg/ m2 pendant 5 jours tous les 28 jours) a
été réalisée chez des patients présentant un méla-
nome non résécable de stade IIIc/ IV. Cette étude,
qui a inclus au total 655 patients (n = 328 dans le
bras trémélimumab et n = 327 dans les bras dacar-
bazine et témozolomide), a été arrêtée après les
résultats de l’analyse intermédiaire en raison d’une
absence d’efficacité sur la survie sans métastases
à distance et d’une SG (critère principal de l’étude)
comparable (11,8 mois dans le bras trémélimumab,
versus 10,7 mois dans les bras dacarbazine et témo-
zolomide).
Chez des patients atteints d’un mélanome non résé-
cable de stade III/ IV en échec de traitement, une étude
de phase II (5) a évalué l’efficacité du trémélimumab
15 mg/ kg tous les 3 mois pendant 4 cycles, ou jusqu’à
progression ou survenue d’une toxicité limitante.
Le critère principal d’évaluation de l’étude était le
pourcentage de RO ; l’essai était considéré comme
positif en cas de bénéfice d’au moins 10 %. Au total,
251 patients (241 évaluables) ont été inclus, et les
résultats ne retrouvent que 8,3 % de RO (20 RP) et
un bénéfice clinique de 22,8 % (RO + stabilisations).
La SG médiane est de 10 mois, et la plupart des effets
indésirables liés à l’administration du traitement ont
été d’intensité légère à modérée (essentiellement
des diarrhées [11,4 %] pour les effets indésirables de

La Lettre du Cancérologue • Supplément 5 au n° 7 - Vol. XVII - septembre 2008 | 19
ACTUALITÉS
ASCO 2008
grade 3/ 4). Les auteurs en concluent que le taux de
réponse de ce traitement de deuxième ligne ne parvient
pas à dépasser le seuil fixé à 10 %, mais que la durée
de cette réponse suggère que le trémélimumab a une
certaine activité dans ce type de population.
Un autre essai de phase I/ II (6) a été réalisé avec le
trémélimumab (15 mg/ kg tous les 3 mois) associé
à l’IFNα-2b à forte dose (induction à raison de
20 MUI/ m2 5 jours/ sem. en i.v. pendant 4 semaines,
puis en entretien sur 8 semaines à la dose de
10 MUI/ m
2
x 3/ sem. en sous-cutané), incluant
dans un premier temps (12 semaines) 16 patients
(rechutes de mélanome inopérable de stade IV :
4 M1a, 2 M1b, 10 M1c). Ces patients avaient tous
été prétraités pour leur maladie métastatique (1 à
5 lignes de traitement) et deux d’entre eux présen-
taient des métastases cérébrales stabilisées sous
traitement. L’essai, étant considéré comme positif
(19 % de RP avec une toxicité acceptable correspon-
dant au profil de toxicité attendu de l’IFNα-2b), a
été poursuivi et 21 patients supplémentaires ont été
inclus (trémélimumab 15 mg/ kg tous les 3 mois et
IFNα-2b à la dose de 10 MUI/ m2 x 3/ sem. en sous-
cutané). Une réponse a été observée à la fois dans
les formes M1a (n = 1) et M1c (n = 2).
Enfin, une étude (7) a évalué l’efficacité du tréméli-
mumab sur 10 patients prétraités qui l’ont reçu en
monothérapie (une fois tous les 3 mois à raison de
10 mg/ kg). Les résultats de l’étude des différentes
populations lymphocytaires (avant le début de l’admi-
nistration du traitement, puis un mois et deux mois
après) montrent une résistance des lymphocytes des
patients à l’effet immunosuppresseur des lympho-
cytes T régulateurs. Cette réponse biologique semble
corrélée aux critères d’efficacité habituels (SSR, SG).
Traitement du glioblastome
CDX-110 – vaccin récent dont tout le monde
parle – vise la variante III d’EGFR présente dans
40 % des glioblastomes, alors que les traitements
habituels par Ac monoclonaux visant EGFR sont
inefficaces sur cette variante. Associé au traitement
standard (radio-chimiothérapie avec témozolo-
mide et témozolomide en adjuvant), CDX-110 a
permis de multiplier par 2 les survies médianes.
Les données actualisées de l’étude de phase II
ACTIVATE (n = 21) et de son étude de suivi ACT II
(n = 23) ont été présentées à l’ASCO (8). Dans
l’étude ACTIVATE, après résection, radiothérapie
et administration de témozolomide 75 mg/ m2/ j
jusqu’à progression, le CDX-110 a été coadmi-
nistré avec du G-CSF (142 mcg) par voie intra-
dermique (pour les 3 premières vaccinations : à
2 semaines d’intervalle pour 16 patients – placebo
pour 5 patients puis tous les mois pour l’ensemble
des patients jusqu’à progression). Le protocole
d’ACT II était comparable, excepté pour le témozo-
lomide en maintenance pour lequel deux schémas
ont été étudiés : 200 mg/ m2 pendant 5 jours tous
les 28 jours (n = 13) ou 100 mg/ m
2
en continu
(21 jours sur 28 ; n = 10) pour un maximum de
12 cycles. Les résultats (tableau) sont extrêmement
encourageants, témoignant d’un allongement très
significatif de la SG et de la SSP. Aucun effet indé-
sirable jugé sérieux n’a été observé dans l’étude
ACTIVATE, et seules des réactions au niveau du site
d’injection ont été observées dans l’étude ACT II.
D’ores et déjà, les inclusions de l’étude AVANT ont
commencé, cette étude de phase IIb faisant partie
intégrante de l’étude de phase IIb/ III ACT III, qui a
prévu d’inclure 90 patients dans 20 centres nord-
américains.
Tableau. Principaux résultats des études ACTIVATE et ACT II.
Bras CDX-110
Contrôle historique
p
ACTIVATE (n = 21)
Survie médiane (mois)
Délai jusqu’à progression (mois)
26
14,2
15,2
7,13
0,0001
0,0001
ACT II (n = 23)
Survie médiane (mois)
Délai jusqu’à progression (mois)
33,1
16,6
15,2
6,4
0,0078
–
1. Urba WJ, Weber JS, O’Day SJ et al. Long-term survival of
patients with advanced melanoma who received ipilimumab
administered at 10 mg/ kg every 3 weeks for 4 doses (induction
dosing). J Clin Oncol 2008;26(Suppl. 15):abstract 3018.
2. Wolchok JD. Antitumor response and new lesions in
advanced melanoma patients on ipilimumab treatment.
J Clin Oncol 2008;26(Suppl. 15):abstract 3020.
3. Eggermont AM, Suciu S, Ruka W et al. EORTC 18961:
post-operative adjuvant ganglioside GM2-KLH21 vaccination
treatment vs observation in stage II (T3, T4N0M0) mela-
noma: 2nd interim analysis led to an early disclosure of the
results. J Clin Oncol 2008;26(Suppl. 15):abstract 9004.
4. Ribas A, Hauschild A, Kefford R et al. Phase III, open-
label, randomized, comparative study of tremilimumab
(CP-675, 206) and chemotherapy (temozolomide or dacar-
bazine) in patients with advanced melanoma. J Clin Oncol
2008;26(Suppl. 15):abstract LBA9011.
5. Kirkwood JM, Lorigan P, Herseyet P al. A phase II
trial of trémélimumab (CP-675-206) in patients with
advanced refractory or relapsed melanoma. J Clin Oncol
2008;26(Suppl. 15):abstract 9023.
6. Tarhini AA, Moschos SS, Schlesselman JJ et al. Phase II
trial of combination biotherapy of high-dose interferon
alfa-2b and trémélimumab for recurrent inoperable
stage III or stage IV melanoma. J Clin Oncol 2008;
26(Suppl. 15):abstract 9009.
7. Ghiringhelli F, Menard C, Mateus C et al. Effect of
CTLA-4 blockade on lymphocyte resistance to regula-
tory T cells in advanced melanoma and use as a surrogate
marker of efficacy of trémélimumab. J Clin Oncol 2008;
26(Suppl. 15):abstract 3021.
8. Sampson JH, Archer GE, Bigner DD et al. Effect of
EGFRvIII-targeted vaccine (CDX-110) on immune response
and TTP when given with simultaneous standard and
continuous temozolomide in patients with GBM. J Clin
Oncol 2008;26(Suppl. 15):abstract 2011.
Références bibliographiques
1
/
3
100%