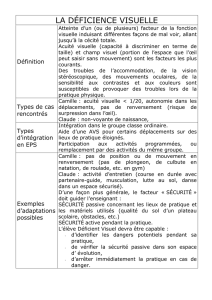
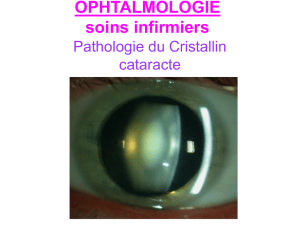
U Épithéliopathie en plaques : une évolution clinique atypique Cas clinique

Rétine
Images en Ophtalmologie
•
Vol. V
•
n° 3
•
juillet-août-septembre 2011
100
Cas clinique
Légendes
Figures 1 et 2. Tâches jaunâtres sous-
rétiniennes, disséminées au pôle postérieur
Figures 3 à 6. Séquence angiographique
typique d’une épithéliopathie en plaques
avec des tâches hypofl uorescentes aux temps
précoces qui deviennent iso- puis hyperfl uo-
rescentes aux temps tardifs en fl uorescéine.
Figures 7 et 8. Angiographie au vert d’indo-
cyanine (ICG) aux temps tardifs : les tâches
restent hypofl uorescentes tout au long de
la séquence.
Épithéliopathie en plaques
• Maladie de Harada • Angio-
graphie • OCT • Corticoïdes.
APMPPE • Harada disease
• Angiography • OCT • Cortico-
steroids.
Épithéliopathie en plaques :
une évolution clinique atypique
Acute Posterior Multifocal Placoid Pigment
Epitheliopathy (APMPPE): an atypical clinical
evolution
J. Perol, S. Michée, T. Grenet, S. Buff et, F. Fajnkuchen, G. Chaine
(Service d’ophtalmologie, hôpital Avicenne, Bobigny)
Une patiente de 50 ans, asthmatique, est adressée dans notre service pour
une baisse d’acuité visuelle bilatérale depuis quelques jours, prédominante
à gauche, accompagnée de céphalées très invalidantes.
Examen
L’acuité visuelle est de 6/10P3 à l’œil droit et de 1/10P10 à l’œil gauche. Le segment
antérieur et le vitré sont calmes. Les clichés couleurs
(fi gures1 et2)
et monochroma-
tiques du fond d’œil retrouvent des tâches jaunâtres, polycycliques, sous-rétiniennes
au pôle postérieur. Une discrète hyperhémie papillaire ainsi qu’une anastomose
artério-veineuse rétino-rétinienne juxtapapillaire peuvent être notées à l’œil gauche.
Lors de l’angiographie à la fl uorescéine
(fi gures3 à6)
, les tâches hypofl uorescentes
aux temps précoces deviennent iso- puis hyperfl uorescentes aux temps tardifs, et l’on
observe également une hyperfl uorescence papillaire gauche. Sur l’angiographie au
vert d’indocyanine
(fi gures7 et8)
, ces tâches restent hypofl uorescentes tout au long
de la séquence. La tomographie par cohérence optique (OCT) réalisée retrouve, à l’œil
gauche, de multiples décollements séreux rétiniens (DSR) cloisonnés, ainsi qu’une
volumineuse logette kystique maculaire au contenu hétérogène
(fi gure9)
.
Discussion et évolution
La patiente est hospitalisée en médecine interne pour la réalisation d’un bilan étio-
logique comprenant un bilan infl ammatoire, infectieux et auto-immun, ainsi qu’une
ponction lombaire afi n d’éliminer une maladie de Harada. L’ensemble de ce bilan
s’avère négatif.
Devant ce cas d’épithéliopathie en plaques, la baisse d’acuité visuelle sévère asso-
ciée à des céphalées et une papillite nous pousse à traiter la patiente par 3bolus
de méthylprednisolone avec un relais per os pour 1mois. Le traitement permet la
résolution rapide des céphalées et des DSR
(fi gure10)
ainsi qu’une remontée rapide
de l’acuité visuelle.
La patiente se présente 1mois plus tard, 48heures après l’arrêt des corticoïdes, pour
récidive des céphalées et baisse d’acuité visuelle de l’œil droit à 2/10P8. L’examen OCT
réalisé retrouve une lame de DSR ainsi qu’un œdème rétinien en interpapillo maculaire
(fi gure11)
. La reprise de la corticothérapie permet la résolution de l’ épisode.
IO-V3-NN-0911.indd 100 06/09/11 17:42

Rétine
Images en Ophtalmologie
•
Vol. V
•
n° 3
•
juillet-août-septembre 2011
101
Cas clinique
1
3
5
7
2
4
6
8
IO-V3-NN-0911.indd 101 06/09/11 17:42

Rétine
Images en Ophtalmologie
•
Vol. V
•
n° 3
•
juillet-août-septembre 2011
102
Cas clinique
Légendes
Figure 9. Décollements séreux rétiniens
multiples et logette maculaire kystique à
la tomographie par cohérence optique de
l’œil gauche.
Figure 10. Normalisation de la tomo graphie
par cohérence optique de l’œil gauche à
1 mois.
Figure 11. Réapparition de décollements
séreux rétiniens 1 mois plus tard à l’œil droit.
Ce cas illustre bien l’existence de formes frontières entre l’épithéliopathie en plaques
et la maladie de Harada
(1)
. En effet, si l’aspect angiographique est typique et si
l’existence de DSR se retrouve dans l’épithéliopathie en plaques
(2)
, ce phénomène
de “corticosensibilité” avec rechute à l’arrêt du traitement nous paraît tout à fait
atypique
(3)
.
II
Références bibliographiques
1.
Wright BE, Bird AC, Hamilton AM. Placoid pigment epitheliopathy and Harada’s disease.
BrJOphthalmol 1978;62(9):609-21.
2.
Bird AC, Hamilton AM. Placoid pigment epitheliopathy. Presenting with bilateral serous retinal
detachment. Br J Ophthalmol 1972;56(1):881-6.
3.
Vedantham V, Ramasamy K. Atypical manifestations of acute posterior multifocal placoid pigment
epitheliopathy. Indian J Ophthalmol 2006;54(1):49-52.
Le VGEF Trap-Eye :
excellents résultats
de 2études de phaseIII
dans le traitement de la DMLA
Dans les 2études VIEW1 et VIEW2, le
VGEF Trap-Eye s’est montré non inférieur
au ranibizumab dans le traitement de la
dégénérescence maculaire liée à l’âge avec
néo-vascularisation (DMLA humide), et ce
dans tous les schémas, y compris avec une
injection tous les 2mois, en atteignant le
critère d’évaluation principal par rapport au
traitement standard (ranibizumab administré
tous les mois). Les études de non-infériorité
évaluaient la proportion de patients dans les
2groupes ayant maintenu ou amélioré leur
acuité visuelle au cours des 52semaines
d’étude.
Dans l’étude VIEW1, menée par Rege-
neron en Amérique du Nord auprès de
1 217 patients, l’acuité visuelle n’a pas
diminué chez 96 % des patients recevant
0,5mg de VGEF Trap-Eye 1fois par mois,
95 % de ceux en recevant 2mg, 1fois par
mois ou tous les 2mois, comparativement
à 94 % de ceux traités par 0,5mg de ranibi-
zumab 1fois par mois. Dans l’étude interna-
tionale VIEW2, menée par Bayer HealthCare
et incluant 1 240patients, l’acuité visuelle n’a
pas diminuée chez 96 % des patients rece-
vant 0,5mg ou 2mg de VGEF Trap-Eye 1fois
par mois ou 2mg tous les 2mois, comparati-
vement à 94 % de ceux traités par 0,5mg de
ranibizumab 1fois par mois.
Le maintien de l’acuité visuelle a été défi ni
comme la perte de moins de 3lignes (équiva-
lentes à 15lettres) sur l’échelle de référence
ETDRS
(Early Treatment Diabetic Retino-
pathy Study)
.
Sur la base de ces résultats, Bayer Health-
Care et Regeneron prévoient de soumettre
des demandes d’autorisation de mise sur le
marché en Europe et aux États-Unis pour le
VGEF Trap-Eye.
Le VGEF Trap-Eye est une protéine de fusion
totalement humaine composée des récep-
teurs solubles de type1 et2 du VGEF qui se
lie à toutes les formes de VGEF-A ainsi qu’au
facteur de croissance placentaire qui lui est
apparenté. C’est un inhibiteur spécifi que et
très puissant de ces facteurs de croissance.
Il est spécifi quement purifi é et contient des
concentrations iso-osmotiques d’un tampon,
ce qui permet son injection dans l’œil.
Les résultats des études VIEW montrent que
le VGEF Trap-Eye peut permettre de changer
la prise en charge thérapeutique de la DMLA
humide avec une administration tous les
2mois sans la nécessité de visites de sur-
veillance ou pour adapter le traitement dans
l’intervalle.
MP
Première étude comparative
dans l’occlusion de branche
veineuse rétinienne lancée
enEurope et en Israël
Allergan France vient d’annoncer le lan-
cement de l’étude COMO
(Comparison of
Intravitreal Dexamethasone Implant and
Ranibizumab for Macular Œdema)
, première
étude comparative menée dans l’occlusion
de branche veineuse rétinienne (OBVR).
L’OBVR touche, chaque année, en Europe,
300 000personnes. C’est une cause fré-
quente de perte de vision. L’objectif de l’étude
COMO est d’évaluer l’effi cacité de 2traite-
ments dans cette pathologie : Ozurdex
®
(implant intravitréen de dexaméthasone
0,7mg) versus ranibizumab.
Cette étude d’une durée de 12mois va inclure,
à partir de l’été2011, dans 36centres en
Europe et en Israël, environ 400patients
souffrant d’OBVR depuis moins de 90jours.
Les patients seront randomisés en 2bras : un
groupe dexaméthasone0,7mg avec une injec-
tion intravitréenne au premier jour renouvelée
5mois plus tard et au10
e
ou 11
e
mois si néces-
saire ; un groupe ranibizumab avec une injec-
tion intravitréenne chaque mois durant 6mois,
renouvelée chaque mois si besoin entre le6e
et le 11
e
mois. Le critère d’évaluation prin-
cipal sera l’amélioration de la meilleure acuité
visuelle corrigée (MAVC) au 12emois.
Ozurdex
®
est le premier implant intravitréen
biodégradable contenant de la dexamétha-
sone administrée grâce à un applicateur à
usage unique spécialement conçu à cet effet.
La dexaméthasone est lentement libérée sur
une période de plusieurs mois au niveau
du corps vitré et agit sur cette durée pour
contrôler l’œdème et réduire l’infl ammation
causée par l’occlusion. Ozurdex
®
a été lancé,
en France à la mi-février, dans le traitement
de l’œdème maculaire lié à une occlusion
veineuse rétinienne. Il a également reçu
l’avis favorable du CHMP (Committee for
Medicinal Products for Human Use) en avril
dans le traitement des uvéites non infec-
tieuses. Il est distribué en pharmacie et est
administré par les ophtalmologues.
Les injections de ranibizumab sont en
général mensuelles afi n de réduire l’œdème
maculaire. L’étude BRAVO a montré que ce
produit était effi cace dans l’amélioration de
l’acuité visuelle chez les patients atteints
d’œdème maculaire récent dû à une OBVR.
MP
Nouvelles de l’industrie pharmaceutique
Communiqués publicitaires des conférences de presse, symposiums, manifestations organisés par l’industrie pharmaceutique
IO-V3-NN-0911.indd 102 06/09/11 17:42

Rétine
Images en Ophtalmologie
•
Vol. V
•
n° 3
•
juillet-août-septembre 2011
103
Cas clinique
11
10
9
IO-V3-NN-0911.indd 103 06/09/11 17:43
1
/
4
100%