L’ Troubles sexuels, fertilité et épilepsie M

MISE AU POINT
La Lettre du Neurologue - vol. IX - n° 5 - mai 2005
146
L’
épilepsie est une question importante de santé publique
dans de nombreux pays. La prévalence de cette maladie
est estimée entre 5 et 9,3/1 000, avec une prédominance
masculine, à l’exception de la période allant de 10 à 14 ans, où la
prédominance est féminine. L’hypofertilité et les troubles sexuels
chez les patient(e)s épileptiques sont connus et ont été décrits pour
la première fois en 1954 par Gastaut et Collomb (1). En effet, à
la fois l’épilepsie et les médicaments antiépileptiques peuvent
altérer la fonction de l’axe hypothalamo-hypophyso-gonadique
chez la femme et chez l’homme. Ce dysfonctionnement peut
donc affecter la fonction endocrine et exocrine des gonades et, en
conséquence, la fertilité et la sexualité. Ces troubles sont d’autant
plus marqués que l’épilepsie est apparue dans l’enfance et qu’ils
sont proportionnels à la fréquence des crises.
RAPPEL PHYSIOLOGIQUE DE LA FONCTION GONADIQUE
L’axe hypothalamo-hypophysaire intervient dans le contrôle de
la fonction de reproduction dans l’espèce humaine, aussi bien
chez l’homme que chez la femme.
✔ Chez l’homme
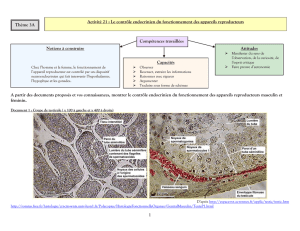
Cet axe s’organise de manière assez simple (figure 1). Des neurones
hypothalamiques sécréteurs libèrent une neuro-hormone, la GnRH
(gonadotrophin-releasing hormone) de façon pulsatile, avec des
pics toutes les 60 à 90 minutes.
Au niveau de l’hypophyse, la GnRH stimule la sécrétion de deux
hormones au niveau des cellules gonadotropes hypophysaires : la
FSH (follicular stimulating hormone) et la LH (luteinizing hor-
mone).
La LH stimule les cellules interstitielles, ou cellules de Leydig
(situées entre les tubes séminifères). La première étape de cette
stimulation est constituée par la reconnaissance et la liaison de
l’hormone (LH) à un récepteur spécifique. Ce récepteur est situé
en majorité dans la membrane plasmique. L’interaction hormone-
récepteur induit l’activation de l’adénylcyclase, la production
d’AMPc, l’activation des protéines kinases, la synthèse et l’acti-
vation des enzymes de la chaîne stéroïdogénique et la production
de testostérone. Cette nouvelle hormone agit à différents niveaux,
permettant la formation des spermatozoïdes et l’acquisition des
caractères sexuels secondaires masculins.
En synergie avec la FSH, les androgènes induisent la synthèse de
* Département de génétique, cytogénétique et embryologie, unité fonctionnelle
de biologie de la reproduction, groupe hospitalier de la Pitié-Salpêtrière, Paris.
Tr oubles sexuels, fertilité et épilepsie
Sexual disorders, fertility and epilepsy
●I. Hammoud*, C. Poirot*
■Prévalence élevée des troubles endocriniens gonadiques
liés aux crises d’épilepsie et au traitement antiépileptique.
■Deux mécanismes sont impliqués :
– perturbation de la pulsatilité de la GnRH et de la LH par
le biais des crises ;
– élévation de la SHBG par les traitements inducteurs enzy-
matiques.
■Forte association entre la prise de valproate de sodium (VPA)
et les troubles endocriniens des ovaires, mais ces derniers sont
souvent réversibles après un changement de traitement.
Mots-clés : Épilepsie – Ovaires polykystiques – Spermato-
genèse.
POINTS FORTS
POINTS FORTS
Epilepsy and drugs used to treat epilepsy may affect the
sexuality and the fertility of patients, because of an alteration
of the hypothalamic-pituitary axis and of a resulting endocrine
and exocrine gonadal alterated function.
For epileptic women, either treated or not, menstrual pertur-
bations are frequent as well as polycystic ovary syndrome.
For epileptic men, and mostly for those who are treated,
spermatogenesis can be impaired.
Assisted reproductive technologies can be helpful. A multi-
disciplinary management between neurologists, gynaeco-
logists, embryologists, endocrinologists and psychiatrists is
necessary in order to suggest the best strategy.
Keywords: Epilepsy – Polycystic ovary – Spermatogenesis.
SUMMARY
SUMMARY

La Lettre du Neurologue - vol. IX - n° 5 - mai 2005 147
l’ABP (androgen-binding-protein), qui transporte la testostérone
et la dihydrotestostérone dans les tubes séminifères où les sté-
roïdes sont indispensables pour la spermatogenèse et la spermio-
genèse.
En retour, on observe un double rétrocontrôle :
– par la testostérone : si la LH est le principal facteur de régulation
de la sécrétion de testostérone, celle-ci exerce un rétrocontrôle
sur la sécrétion de LH, en inhibant la production de la GnRH
(hypothalamus) et de la LH (hypophyse) ;
– par l’inhibine : les cellules de Sertoli, sous l’influence des
androgènes (testostérone et dérivés), synthétisent des inhibines,
qui inhibent la production de la FSH hypophysaire.
✔ Chez la femme
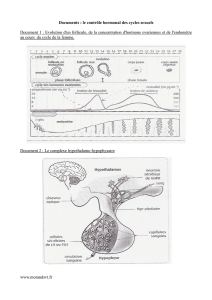
L’axe gonadotrope s’organise de la même façon que chez l’homme.
Des neurones hypothalamiques sécrètent de façon pulsatile la
GnRH. La durée des pulses est la même que chez l’homme.
La GnRH stimule la sécrétion de deux hormones hypophysaires :
la FSH et la LH, qui sont nécessaires à la folliculogenèse et à la
maturation ovocytaire.
La FSH et la LH ont respectivement pour cible les cellules de la
granulosa et les cellules de la thèque interne au niveau de l’ovaire.
Ces cellules ovariennes sécrètent deux types d’hormones : les
estrogènes (dont l’estradiol), et la progestérone, qui agissent
au niveau de divers organes cibles, permettant la réalisation de
la fonction de reproduction. De plus, ces hormones agissent en
rétroaction de manière variable selon leur concentration plasma-
tique.
PHYSIOPATHOLOGIE
Les crises d’épilepsie entraînent des troubles neuroendocriniens
par altération de l’axe hypothalamo-hypophysaire. Le mécanisme
pathogénique des dysfonctions neuroendocriniennes chez les
patients épileptiques n’est pas clair. Le site de dysfonctionnement
est probablement situé dans l’hypothalamus et/ou dans les aires
Le cycle menstruel peut être divisé en deux phases :
– La phase folliculaire (première moitié du cycle) est carac-
térisée par la croissance d’une nouvelle série de follicules ova-
riens, induite par l’élévation des taux de FSH. Alors que la sécré-
tion de progestérone est quasi absente, le taux d’estradiol, stimulé
par la LH et la FSH, augmente d’abord lentement, puis, à mesure
que la maturation folliculaire progresse, plus rapidement. Un pic
d’estradiol survenant un peu avant la moitié du cycle est suivi
d’une décharge de FSH et de LH (rétrocontrôle positif), ce qui
permet la réalisation des étapes finales de maturation folliculaire
et de l’ovulation.
– La phase lutéinique : après l’ovulation, le follicule ovarien se
transforme en corps jaune qui produit de la progestérone. Cette
hormone exerce une rétroaction négative sur l’axe hypothalamo-
hypophysaire, réduisant ainsi les sécrétions de GnRH, FSH et
LH. Dans le même temps, la synthèse d’estrogènes par l’ovaire
diminue : leur concentration plasmatique repasse sous la valeur-
seuil de 200 pg/ml, et ces hormones retrouvent un rôle de rétro-
contrôle négatif (figure 2).
Hypothalamus
GnRH-Neurones
peptidergiques
GnRH
HYP. –
LH
–
FSH
Testicule
TestostéroneInhibine
Figure 1. Le système de contrôle de la gonadotrophine chez l’homme.
Hypothalamus
GnRH-Neurones
peptidergiques
GnRH
HYP.
LHFSH
–+
?
EstrogèneProgestérone
Ovaire
+
–
Figure 2. Le système de contrôle de la gonadotrophine chez la femme.

MISE AU POINT
La Lettre du Neurologue - vol. IX - n° 5 - mai 2005
148
suprahypothalamiques. En effet, dans les conditions de fonctionne-
ment normales, les neurones sont organisés en réseaux complexes,
en état d’équilibre permanent entre des mécanismes excitateurs
et inhibiteurs. La crise survient lorsque certains de ces réseaux
échappent aux processus de contrôles physiologiques en raison
soit d’une perturbation du fonctionnement de certains canaux
ioniques transmembranaires, soit de connexions synaptiques
aberrantes, soit d’un déficit de la neuromédiation inhibitrice
médiée par l’acide gamma-aminobutyrique (GABA), soit d’un
excès de la neuromédiation excitatrice médiée par le glutamate,
ce qui entraîne des troubles de la pulsatilité de la GnRH, d’où des
changements de la fréquence de pulsatilité de la LH, et donc une
dysfonction des gonades [figure 3] (2).
Par ailleurs, les médicaments antiépileptiques inducteurs enzy-
matiques modifient les taux des hormones par augmentation de la
synthèse hépatique de la SHBG (sex hormone binding globulin)
et augmentent le catabolisme des hormones stéroïdiennes. La
SHBG est la protéine de liaison des hormones stéroïdes sexuelles
dans le plasma (en liant les stéroïdes, la SHBG régule leur bio-
disponibilité et contrôle leur accès vers les cellules cibles. Elle
maintient ainsi l’équilibre entre les effets biologiques respectifs
des androgènes et des estrogènes).
HORMONES ET CRISES D’ÉPILEPSIE
La fréquence et la sévérité des crises d’épilepsie peuvent changer
au moment de la puberté, du cycle menstruel, de la grossesse et
de la ménopause par fluctuation des hormones stéroïdiennes.
En effet, chez les femmes épileptiques, les hormones stéroïdiennes
gonadiques altèrent l’excitabilité des neurones du système nerveux
central. Ainsi, les estrogènes réduisent la synthèse de la sous-
unité GABA-A des récepteurs GABA, bloquent la transmission
inhibitrice médiée par GABA, augmentent l’excitation du récepteur
du glutamate et le nombre de synapses des neurones excitateurs,
ce qui diminue le seuil de la crise. La progestérone, quant à elle,
a un effet inverse sur le système inhibiteur médié par GABA.
Cette relation entre la fréquence des crises et les taux sériques des
hormones avait fait entrevoir la possibilité d’une thérapie hor-
monale des crises par la progestérone, ce qui s’est avéré être un
échec (3).
EFFETS DE L’ÉPILEPSIE ET DES ANTIÉPILEPTIQUES
SUR LA SEXUALITÉ
✔ Chez la femme
La réduction du désir sexuel est rapportée chez un quart à un tiers
d’entre elles. Le stress social et psychologique qu’elles subissent
est un facteur important contribuant à ce dysfonctionnement. De
plus, un tiers de ces femmes ont des difficultés lors des rapports
sexuels en raison d’une sécheresse vaginale entraînant une dys-
pareunie due à la diminution des estrogènes (4).
✔ Chez l’homme
La plupart des publications ont montré la présence d’un nombre
élevé de troubles sexuels chez les patients épileptiques, en parti-
culier l’impuissance et la diminution de la libido.
Le pourcentage des troubles sexuels chez les patients épileptiques
varie selon les études entre 25 et 70 %. En effet, Murialdo et al.
(5) ont montré que, sur 37 patients épileptiques traités efficacement
par monothérapie, huit se plaignaient d’impuissance ; deux de ces
patients souffraient également d’une perte de la libido. L’élévation
du taux d’estradiol (E2) et la diminution du ratio testostérone
(T/E2)/testostérone libre (Tl/E2) et dihydrotestostérone (DHT/E2)
pourraient expliquer ces troubles sexuels. Il existe, d’autre part,
une faible réponse de la LH au GnRH, ce qui pourrait indiquer
un hypogonadisme hypogonadotrope infraclinique chez ces
patients.
EFFETS DE L’ÉPILEPSIE ET DES ANTIÉPILEPTIQUES
SUR LA FERTILITÉ
Il existe deux grandes classes d’antiépileptiques :
– les antiépileptiques inducteurs enzymatiques ;
– les antiépileptiques non inducteurs enzymatiques.
Les médicaments antiépileptiques inducteurs augmentent la syn-
thèse hépatique de SHBG ainsi que le catabolisme des hormones
sexuelles et des hormones contraceptives ; par conséquent, ils
entraînent une diminution du taux sérique de ces hormones.
✔ Chez la femme
L’existence d’une hypofertilité est controversée. La majorité des
études montre cependant, indépendamment du type des crises,
des troubles de fertilité possibles chez les patientes épileptiques
avec ou sans traitement. Le dysfonctionnement de la sécrétion de
la LH, qui est elle-même liée à l’altération de la sécrétion du
GnRH, entraîne des perturbations gonadiques qui se traduisent
par des troubles des taux des hormones gonadiques (ratio estro-
gène/progestérone élevé, prolactine élevée) avec une intensité
variable des signes cliniques.
Figure 3. Suggestion de la relation entre le dysfonctionnement du système
de neurotransmission, l’épilepsie et les troubles endocriniens.
Baisse du seuil de crise Dysfonctionnement de neurotransmission
Épilepsie
Décharges paroxystiques Troubles de pulsatilité de GnRH
Hypo- ou hyperpulsatilité de LH
Troubles endocrines des gonades
Facteurs additionnels
(type, sévérité, durée)

La Lettre du Neurologue - vol. IX - n° 5 - mai 2005 149
La proportion de femmes présentant des troubles menstruels
varie de 50 à 20 % selon les études.
Cinquante pour cent des femmes épileptiques ont des troubles du
cycle menstruel (16 % d’aménorrhée, 20 % d’oligoménorrhée et
20 % de cycles irréguliers), alors que ce taux n’est que de 5 %
dans la population générale. Douze pour cent ont une aménorrhée
hypogonadotrope hypogonadique, contre seulement 1,5 % dans la
population générale (6). Ces anomalies sont retrouvées chez les
femmes épileptiques traitées ou non traitées. Nappi et al. (2), quant
à eux, n’ont retrouvé que 25 % de troubles du cycle menstruel.
Plusieurs études chez les femmes épileptiques ont montré une
relation de cause à effet entre les traitements antiépileptiques et
les troubles endocriniens. En particulier, le valproate de sodium
(VPA) pourrait induire une hyperandrogénie, des ovaires poly-
cystic-like (OPK) et des troubles menstruels (7).
Ainsi, Isojärvi (7) a étudié pendant 12 mois l’effet de l’arrêt du VPA
remplacé par la lamotrigine chez 60 femmes épileptiques souf-
frant de troubles endocriniens (obésité, hyperandrogénisme, OPK).
Cette étude a montré une diminution significative de l’obésité et du
taux des hormones androgéniques. De plus, 9 des 20 femmes pré-
sentant initialement des ovaires polykystiques n’en avaient plus.
Les effets des traitements antiépileptiques sur la fertilité chez les
femmes sont contradictoires. En revanche, il est bien montré que
la mise sous contraceptif oral contenant de faibles doses d’éthinyl-
estradiol (< 35 g) ou des progestatifs seuls chez les patientes
traitées par antiépileptiques inducteurs enzymatiques (phéno-
barbital, carbamazépine, topiramate et oxcarbamazépine) peut
être inefficace, le taux d’échec de la contraception étant estimé à
7%,comparativement à un taux de 1 à 2% dans une population
normale.
✔ Chez l’homme
Bien que peu d’études aient été publiées sur ce sujet, l’atteinte de
la spermatogenèse paraît incontestable chez les patients épilep-
tiques avec ou sans médicaments antiépileptiques. Dans une étude
ancienne, Christiansen et Lund (8) ont étudié les effets des médica-
ments antiépileptiques sur les différents paramètres spermatiques
chez 98 patients épileptiques. Cette étude montrait que 50 % des
patients avaient un volume éjaculatoire bas (n = 2-6 ml), 57 %
une diminution du nombre de spermatozoïdes (n = 20 à 200 mil-
lions/ml), 89 % des anomalies morphologiques des spermato-
zoïdes (n > 30 % de formes typiques) et 96 % une hypofertilité.
Roste et al. (9) ont, quant à eux, publié une étude évaluant les
effets des antiépileptiques sur les fonctions sexuelles et les para-
mètres spermatiques chez 36 patients épileptiques sous mono-
thérapie (16 sous VPA et 20 sous carbamazépine [CBZ]) comparés
à 90 hommes de la population générale. Ces auteurs ne rappor-
tent aucune différence concernant les fonctions sexuelles (libido
et impuissance) entre le groupe sous CBZ, le groupe sous VPA et
la population générale. En revanche, ils retrouvent une baisse de
la mobilité des spermatozoïdes et du pourcentage de formes
typiques dans les groupes traités par rapport au groupe témoin.
Cependant, ils n’ont pas trouvé de différence concernant le
volume testiculaire et les autres paramètres spermatiques entre
les divers groupes.
Dans une autre étude plus récente, Isojärvi et al. (10) ont évalué les
paramètres suivants : index de masse corporelle (IMC), dosages
hormonaux sériques, paramètres spermatiques, échographie tes-
ticulaire, volume testiculaire, chez 60 patients épileptiques sous
monothérapie (15 patients sous CBZ, 18 sous oxcarbazépine
[OXC] et 27 sous VPA) comparés à 41 hommes de la population
générale. Les patients traités par CBZ ont une élévation du taux
de déhydroépiandrostérone sulfate et ceux traités par VPA ont
une diminution du taux d’androstènedione par rapport à la série
témoin. Il n’existe pas de différence au niveau hormonal entre le
groupe sous OXC et les séries témoins. En revanche, ces théra-
peutiques, et surtout le VPA, entraînaient une diminution de la
numération spermatique, de la mobilité et du pourcentage de
formes typiques des spermatozoïdes. Enfin, les patients traités
par VPA ont un IMC supérieur et un volume testiculaire inférieur
à celui des sujets appartenant aux autres groupes.
PRISE EN CHARGE DES TROUBLES DE LA FERTILITÉ
PAR LES TECHNIQUES D’ASSISTANCE MÉDICALE
À LA PROCRÉATION
Les indications d’assistance médicale à la procréation (AMP)
chez les patients épileptiques sont diverses et ne sont pas systé-
matiquement dues à la maladie elle-même ni à son traitement. La
prise en charge des couples où au moins un des conjoints est épi-
leptique ne pose en général pas de problèmes particuliers.
Le recours aux techniques d’AMP dépend des critères classiques
de prise en charge des couples hypofertiles. Par exemple, en cas
de stérilité tubaire, une fécondation in vitro est indiquée ; en cas
d’altération importante des paramètres spermatiques, une injec-
tion intracytoplasmique d’un spermatozoïde (ICSI) est effectuée.
Néanmoins, il est important de tenir compte de certaines parti-
cularités.
Chez l’homme épileptique, des troubles de l’érection ou l’absence
d’éjaculation peuvent aboutir à un échec du recueil de sperme. Il
est alors fortement conseillé au patient de faire une autoconser-
vation de sperme avant la tentative d’AMP pour pallier un éven-
tuel échec du recueil de sperme le jour de celle-ci, échec qui n’est
pas sans laisser de traces, tant physiques que psychologiques. De
la même façon, en cas de dégradation rapide des paramètres sper-
matiques, une autoconservation de sperme sera prescrite.
Chez les femmes épileptiques, dont on sait qu’elles sont sensibles
aux variations hormonales, et en particulier des estrogènes, on ne
retrouve pas, paradoxalement, de publications faisant état d’un
risque lié à la stimulation de l’ovulation souvent nécessaire en
AMP, et donc d’un risque accru de crises liées à l’hyperestro-
génie induite. Les patientes traitées par des antiépileptiques
inducteurs enzymatiques ou par le VPA et ayant développé un
aspect d’ovaires polycystic-like pourraient peut-être bénéficier,
en accord avec les neurologues, d’une modification de traitement.
Si le traitement ne peut être modifié, il est possible d’avoir recours
à l’AMP en cycle spontané ou à la maturation ovocytaire in vitro,
technique consistant à prélever des ovocytes immatures en dehors
de tout traitement hormonal et de les faire maturer in vitro. Cette

MISE AU POINT
La Lettre du Neurologue - vol. IX - n° 5 - mai 2005
150
nouvelle technique d’AMP semble très prometteuse, et ce d’autant
plus que la patiente a développé un syndrome des ovaires poly-
kystiques.
CONCLUSION
L’épilepsie et les médicaments épileptiques peuvent affecter la
sexualité et la fertilité de façon variable. Dans le cadre de l’AMP,
la prise en charge de l’hypofertilité chez les patient(e)s épilep-
tiques doit être complète, et nécessite une collaboration étroite entre
les différentes disciplines médicales (endocrinologie, neurologie,
gynécologie, psychiatrie et biologie d’AMP).
■
RÉFÉRENCES BIBLIOGRAPHIQUES
1.
Gastaut H, Collomb H. Étude du comportement sexuel chez les épileptiques
psychomoteurs. Ann Med Psychol 1954;112,2(5):657-96.
2.
Nappi C, Meo R, Bilo L. Reduced fertility and neuroendocrine dysfunction in
women with epilepsy. Gynecol Endocrinol 1994;8:133-45.
3.
Herzog AG. Psychoneuroendocrine aspects of temporolimbic epilepsy. Part II:
Epilepsy and reproductive steroids. Psychosomatics 1999;40:102-8.
4.
Morrell MJ, Sperling MR, Stecker M, Dichter MA. Sexual dysfunction and partial
epilepsy: a deficit in physiologic sexual arousal. Neurology 1994;44:243-7.
5.
Murialdo G, Galimberti CA, Fonzi S, Manni R, Tartara A. Sex hormones and
pituitary function in male epileptic patients with altered or normal sexuality. Neuro-
psychobiology 1994;30(1):29-36.
6.
Penovich PE. The effects of epilepsy and its treatment on sexual and reproductive
function. Epilepsia 2000;41(2):S53-S61.
7.
Isojärvi JIT, Laatikainen TJ, Pakarinen AJ, Juntunen KT, Myllyla VV. Polycystic
ovaries and hyperandrogenism in women taking valproate for epilepsy. N Engl J Med
1993;329:1383-8.
8.
Christiansen P, Lund M. Sexual potency, testicular function and excretion of
sexual hormones in male epileptics. In: Janz D (ed). Epileptology: VIIth Epilepsy
International Symposium. Berlin: Thieme Edition and Publishing Sciences Group,
1975:190-1.
9.
Roste LS, Tauboll E, Haugen TB. Alterations in semen parameters in men with
epilepsy treated with valproate or carbamazepine monotherapy. Eur J Neurol
2003;10:501-6.
10.
Isojärvi JIT, Löfgren E. Effect of epilepsy and antiepileptic drugs on male
reproductive health. Neurology 2004;62:247-53.
REMINYL
mentions légales
1
/
5
100%