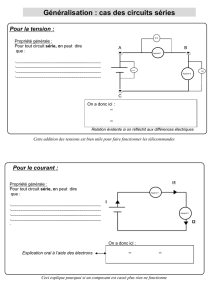
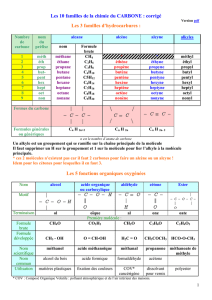
14 09 15 8h 10h willand

2015-2016 Les polyfonctionnels
– UE 6 : Chimie organique et bio-inorganique –
Annexe du cours sur Moodle
Semaine : n°2 (du 14/09/15 au
18/09/15)
Date : 14/09/2015
Heure : de 8h00 à
10h00 Professeur : Pr. Willand
Binôme : n°31 Correcteur : n°33
PLAN DU COURS
I) Les dérivés carbonylés insaturés
A) Différents types de dérivés carbonylés insaturés
1) Insaturés
2) Alpha-bêta insaturés
B) Nomenclature
1) Alpha-énal
2) Alpha-énone
C) Voie d'accès aux énals
1) Rétrosynthèse
2) Synthèse
D) Structure et réactivité
II) Carbonyle alpha-bêta insaturé
A) Structure
B) Stabilité de la forme conjuguée
C) Réaction avec les électrophiles
1) Propriétés chimiques
2) Structure OMHO
3) Réaction avec Br2
D) Réaction avec les nucléophiles
1) 2 sites d'attaque possibles
2) Addition d'organométalliques
3) Réaction de Michaël
4) Addition de Michaël
5) Annélation de Robinson
1/17

2015-2016 Les polyfonctionnels
III) Addition 1,4 en biologie
A) Détoxification par le glutathion
B) Réaction type Michael
IV) Substances actives
A) Mytomycine C
B) Syringolin A et B
C) Neratinib
V) Mobilité des H en gamma
2/17

2015-2016 Les polyfonctionnels
I) Les dérivés carbonylés insaturés
A) Différents types de dérivés carbonylés insaturés
1) Insaturés
Lorsqu'on trouve une liaison simple entre une double
liaison, on parle de diène conjugué
Il peut être S-trans ou S-cis → rotation autour de la
liaison sigma
2) Alpha-bêta insaturés
Dérivés carbonylés alpha bêta insaturés, ces dérivés sont retrouvés dans des
composés naturels, composés qui dérivent des terpènes (carbone qu'on retrouve dans
la menthe : produit d'oxydation du menthol )
→ double liaison conjuguée à cette cétone
On trouve aussi le cortisol, la testostérone, la progestérone
B) Nomenclature
1) Les alpha-énal :
→ découlent des aldéhydes
•Acroléine (propénal) : alcène + aldéhyde :
•Aldéhyde crotonique (but-2-énal)
•Aldéhyde cinnamique : cycle aromatique (3 phénylpropénal)
Il est le composant principal (90%) de l'essence de cannelle
2) Les alpha-énone
→ découlent des cétones
•Chalcone (1,3-diphénylpropénone)
•Dibenzalacétone (2 double liaisons de chaque
côté de la fonction carbonylée)
3/17

2015-2016 Les polyfonctionnels
C) Voie d'accès aux énals
1) Rétrosynthèse
Exemple : aldéhyde cinnamique → on cherche à le synthétiser
On obtient les alcènes grâce à des réactions de
déshydratation → réaction d'élimination car
perte d'eau.
On fait de la rétrosynthèse (fait de partir de la
fin) pour essayer de trouver les produits de
départ pour obtenir à la fin ce médicament.
Il faut rajouter sur cette structure un atome
d'oxygène et un hydrogène : obtention d'une
molécule d'eau. Celle-ci va être éliminée et
permettra l'obtention du produit final.
Le carbone sp2 devient sp3, on rajoute une
liaison avec la fonction hydroxyle. On rajoute
aussi un hydrogène de l'autre côté.
2eme flèche de rétrosynthèse : On part d'un
dérivé aldéhyde avec un cycle aromatique et de
l'autre côté, (on déconnecte) on obtient aussi un
aldéhyde. On a donc 2 réactifs.
Il faut un nucléophile et un électrophile.
Réactif 1 : Le benzaldéhyde est électrophile
car le carbone est delta + et l'oxygène est delta -
Réactif 2 : Le carbone en alpha présente des
hydrogènes mobiles, on obtient un anion qui
pourra jouer le rôle de nucléophile
4/17

2015-2016 Les polyfonctionnels
2) Synthèse
Si on inverse le chemin : synthèse
•La réaction se fait à partir du
benzaldéhyde et du cétaldéhyde.
Le cétaldéhyde, en présence d'une
base, perd un H au niveau de son
carbone alpha. On obtient donc
une charge négative sur ce
carbone
Ce produit attaque le carbone
électrophile du benzaldéhyde pour
former une liaison sigma.
Délocalisation des électrons pi
vers l'atome le plus
électronégatif.
•2ème étape : formation d'une
liaison sigma
•3ème étape : on a un alcoolate qui
va chercher un proton dans le
milieu réactionnel pour se
stabiliser → obtention d'un alcool
non chargé donc plus stable
= c'est un aldol
•4ème étape : on chauffe la
réaction ce qui va favoriser
l'élimination qui conduit à
l'aldéhyde apha béta insaturé
OH- qui est toujours présent dans
le milieu vient arracher le proton.
On observe le retour des électrons avec l'apparition d'une molécule d'eau
→ formation d'un aldéhyde alpha béta insaturé + H2O
La crotonisation c'est la réaction de déshydratation.
D) Structure et réactivité
Alcène : 2 atomes de carbone sp2 → structure plane avec 6 atomes coplanaires
Région de densité électronique élevée , les alcènes sont des nucléophiles donc peuvent réagir avec des
électrophiles.
5/17
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%