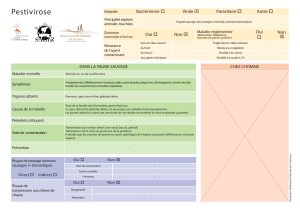
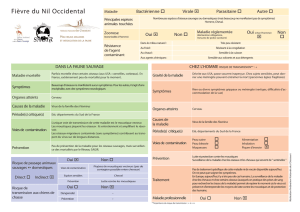
66 SG/13/GT2

66 SG/13/GT2
Original : anglais
octobre 1997
RAPPORT DE LA RÉUNION DU GROUPE DE TRAVAIL DE L'OIE
SUR LES MALADIES DES ANIMAUX SAUVAGES
Paris, 7 - 9 octobre 1997
_____
La réunion du Groupe s'est tenue du 7 au 9 octobre 1997, au Bureau central de l'OIE. Le Docteur J. Blancou, Directeur
général de l'OIE, a ouvert la séance en accueillant les participants (Annexe I). Le Docteur M.H. Woodford a été élu
président de séance et les Drs V. Nettles et M. Artois ont été nommés rapporteurs. L'ordre du jour qui figure à
l’Annexe II a été approuvé.
1. Bilan épidémiologique de certaines maladies des animaux sauvages en 1996-1997
Maladies de la liste A
Peste bovine
Depuis 1994, une épizootie de peste bovine a été signalée chez les ruminants sauvages en Afrique de l’Est. Elle a tout
d’abord été diagnostiquée dans le parc naturel de Tsavo (1994), dans ceux de Meru (1995), d’Amboseli (1995) et de
Nairobi (1996). Le buffle (Syncerus caffer), le grand coudou (Tragelaphus strepsiceros), le petit coudou (Tragelaphus
imberbis), le guib harnaché (Tragelaphus scriptus), l’éland du Cap (Taurotragus oryx) et la girafe (Giraffa
camelopardalis) sont les espèces chez lesquelles on a constaté des manifestations cliniques ou une mortalité. On a par
la suite établi que la peste bovine circulait encore à bas bruit chez les animaux sauvages dans certaines zones du Kenya,
mais il apparaît que la campagne de vaccination de masse, réduisant la propagation de l’infection, a produit de bons
résultats.
En 1997, une maladie épidémique affectant le buffle, le guib harnaché et le dik dik de Kirk (Madoqua kirki) a été
signalée dans le parc national d’Arusha, en Tanzanie. Selon les premières investigations, l’aspect clinique de cette
maladie suggérait fortement la peste bovine, mais le diagnostic n’en a pas été confirmé en laboratoire. Les résultats
négatifs des tests sérologiques pratiqués sur des animaux ayant fait récemment l’objet de prélèvements au Serengeti
(campement de Klein) et dans le cratère du Ngorongoro semblent indiquer que la maladie ne s’est pas propagée vers
l’ouest. Une évaluation du risque et un renforcement des mesures d’observation, ainsi qu'une vaccination du bétail sont
en cours.

2 Maladies des animaux sauvages/ oct. 97
Fièvre aphteuse
Un foyer de fièvre aphteuse, qui avait été identifié l’an dernier chez des impalas (Aepyceros melampus), dans le sud-est
du Parc National Kruger (Afrique du Sud), a semblé avoir atteint son point final sur le plan clinique en septembre 1996.
La souche virale, de type SAT2, en cause dans ce foyer ayant affecté les impalas, a également été isolée dans un
troupeau de buffles (Syncerus caffer), dans la même région du Parc National Kruger. Les souches ainsi isolées ont mis
en évidence le rôle épidémiologique que peut jouer le buffle en tant que réservoir de virus.
Le virus de la fièvre aphteuse n'a pas pu être isolé dans les prélèvements des amygdales ou de la muqueuse pharyngée
effectués aléatoirement sur des impalas dans la région du foyer 6 à 12 semaines après la flambée, alors que certains de
ces animaux portaient des lésions anciennes à leurs sabots et que 33% d’entre eux présentaient des anticorps contre le
virus. Il semble donc que les impalas n'aient pas un rôle important en tant que réservoir de virus pendant les intervalles
entre épizooties.
Au Zimbabwe, un foyer de fièvre aphteuse dû à un virus de type SAT2 a touché des bovins d'une région limitrophe de
la réserve Save Wildlife. Le séquençage des nucléotides de la souche virale a montré que cette infection avait pour
origine des buffles vivant dans la réserve. Etant donné l’existence d’une double barrière destinée à éviter les contacts
entre bétail et buffles, on recherche actuellement si d'autres espèces d'animaux sauvages pourraient avoir été en cause.
Des cas suspects mais non confirmés de fièvre aphteuse ont par ailleurs été signalés chez des impalas dans le Parc
National du Lac Mburo, en Ouganda et chez des girafons à Laïkipia, au Kenya.
Un foyer de fièvre aphteuse a été signalé dans un troupeau semi captif d’oryx d’Arabie (Oryx leucoryx) au Qatar. C’est
la première fois que l’on signale la fièvre aphteuse chez cette espèce. Le virus était de type Asia.
Maladie de Newcastle
Un virus de la maladie de Newcastle a été isolé des cadavres de cormorans à aigrettes (Phalacrocorax auritus) qui
étaient en train de nicher à l’extrémité sud-est de la mer de Salton, en Californie (Etats-Unis d’Amérique). Plus de
1 600 oiseaux ont été retrouvés morts et de nombreux survivants portaient des traces d’affections neurologiques, et
notamment de paralysie des ailes ou des pattes. Le virus isolé appartenait à une souche mésogène modérément
pathogène chez les poulets. On a aussi trouvé des signes de la maladie de Newcastle chez des cormorans à aigrettes
dans deux autres sites des Etats-Unis d'Amérique, à savoir le Bear River Migratory Bird Refuge, dans l'Utah (juin-
juillet 1997), et sur le fleuve Columbia, dans le Comté de Clatsop, Etat de l’Oregon. L’étude du pouvoir pathogène de
ces virus est en cours.
Des vétérinaires canadiens spécialistes des animaux sauvages ont signalé l’existence de la maladie de Newcastle chez
des cormorans en août 1996. Les oiseaux provenaient de l’extrémité orientale du lac Ontario et d’une colonie qui avait
été infectée en 1995. Le virus de la maladie de Newcastle a été isolé par Agriculture et Agri-Food Canada. Un autre cas
a probablement concerné un cormoran à aigrettes, au Nouveau Brunswick (Canada), en octobre 1996. L’oiseau portait
des lésions compatibles avec la maladie et une épreuve immuno-histochimique a donné un résultat positif mais le virus
n’a pas été isolé.
La maladie de Newcastle a été signalée en Finlande chez des pigeons (Columba sp.) et chez des harles (Mergus
merganser).
En janvier 1997, la maladie de Newcastle a affecté un élevage industriel de poulets à Hereford (Royaume-Uni). On a
suspecté des oiseaux sauvages migrateurs d'avoir été à l’origine de l’infection, mais cela n’a pas été prouvé.
Les résultats préliminaires d’une enquête sérologique de grande envergure sur des oiseaux sauvages et commensaux en
Suisse n’a pas mis en évidence une exposition au virus de la maladie de Newcastle.
Peste porcine classique
La peste porcine classique est toujours présente dans divers foyers limités chez des sangliers (Sus scrofa), notamment
en France, en Allemagne et en Italie (notamment en Sardaigne). Aucun nouvel épisode n’a été rapporté en Autriche,
après la flambée qui s’y était produite aux confins de la Slovaquie au début de 1996. Dans la région de Varese (Italie),
au voisinage de la frontière suisse, on a signalé un nouveau foyer (le virus a été isolé à trois reprises, et 50 à
60 sangliers sont morts).

Maladies des animaux sauvages/oct. 97 3
L'existence d'un lien entre réservoirs du virus de la peste porcine classique chez les porcs et les sangliers reste
controversée. Les rapports actuels ne signalent aucun nouveau foyer chez les sangliers à la suite de l’épidémie massive
qui affecte maintenant les élevages porcins aux Pays-Bas. Une surveillance sérologique de grande envergure mise en
oeuvre en France depuis plusieurs années n’a pas pu mettre en évidence la présence d’anticorps sauf dans les régions
infectées de la Moselle et du Bas-Rhin. En revanche, certaines flambées récentes n’ont pas régressé spontanément,
comme on l'espérait. On craint désormais une situation endémique localisée et les experts de l’Union européenne
cherchent les meilleurs solutions pour gérer cette situation.
Maladies de la liste B
Fièvre charbonneuse
La fièvre charbonneuse est répandue dans le monde entier, et sa présence a été mise en évidence chez de nombreux
ongulés et carnivores, périssodactyles et éléphants.
Les foyers suivants, affectant les animaux sauvages, ont été signalés en 1996 :
a) Au Parc National Kruger, en Afrique du Sud, quatre cas ont été confirmés dans la zone d’endémie à l’extrême
Nord du parc. Ils concernaient un éléphant (Loxodonta africana), deux impalas (Aepyceros melampus) et un
grand coudou (Tragelaphus strepsiceros).
b) En Namibie, et plus précisément au Parc National Etosha, la fièvre charbonneuse a été confirmée chez 20 gnous
(Connochaetes taurinus), trois guépards (Acinonyx jubatus), six éléphants, deux gemsboks (Oryx gazella), deux
grands coudous, un rhinocéros noir (Diceros bicornis), une antilope noire (Hippotragus niger), un springbok
(Antidorcas marsupialis), et 25 zèbres (Equus burchelli.
c) En Ouganda, la fièvre charbonneuse a été diagnostiquée chez des cobes de Buffon (Kobus cob) dans le Parc
National Queen Elizabeth.
d) Aux Etats-Unis d’Amérique, la fièvre charbonneuse a affecté des cerfs de Virginie (Odocoileus virginianus)
ainsi que des bovins au Texas.
Maladie d’Aujeszky
Des études effectuées dans trois universités ont révélé que les virus de la pseudorage trouvés chez le sanglier (Sus
scrofa) aux Etats-Unis d'Amérique sont plus souvent présents dans l’appareil génital que dans la muqueuse nasale ou
dans les amygdales. Lorsque des sangliers mâles sont infectés, ils excrètent de grandes quantités de virus par le
prépuce, le virus étant retrouvé en moindre quantité chez les truies. Bien que des infections expérimentales de sangliers
par le virus de la maladie d’Aujeszky isolé de sangliers aient montré que le virus pouvait être transmis, à un degré
limité, par aérosol ou par cannibalisme, les observations actuelles de terrain indiquent que la voie naturelle de la
propagation est vénérienne. Des sangliers possédant des anticorps contre le virus de la maladie d’Aujeszky ont été
signalés dans 98 Comtés répartis dans dix des Etats des Etats-Unis d'Amérique et le taux de prévalence s’établissait
globalement à 27,7 % (4 293 sur 15 494 sangliers examinés).
L’exposition des sangliers au virus de la maladie d’Aujeszky a été mentionnée dans des publications (et des rapports
non publiés) en France, en Allemagne et en Italie. Les résultats obtenus sont le fruit de recherches dispersées, et ne sont
pas représentatifs de l’ensemble de la population. Le taux de prévalence des anticorps dans cette population s’établit
toutefois entre 5 % et 60 %. Les résultats récemment déterminés sur la base d’études allemandes montrent que les virus
isolés de sangliers n’ont pas de lien épidémiologique (dans le temps ou dans l’espace) avec les flambées qui se
produisent dans les élevages porcins. De plus, les analyses biomoléculaires ont mis en évidence des différences
significatives entre les souches en cause.
Échinococcose
Echinococcus multilocularis est un parasite habituel du renard roux (Vulpes vulpes) d’Europe centrale. Des taux de
prévalence atteignant, voire dépassant, 30 % sont fréquents. Cette maladie (qui se manifeste par la présence de kystes
alvéolaires chez l’hôte intermédiaire) peut être transmise à l’homme lorsqu’il dépèce et manipule des renards infectés,
ou consomme des fruits ou des légumes souillés par des excréments de renard. Les rongeurs sont les hôtes
intermédiaires de ce petit cestode.
Certains affirment que la vaccination des renards contre la rage pourrait entraîner un accroissement de la population de

4 Maladies des animaux sauvages/ oct. 97
ces animaux, d’où un risque accru pour l’homme mais il n’existe pas, pour l’heure, d’éléments permettant d’étayer ces
propos.
En Italie Echinococcus granulosus est enzootique chez le loup (Canis lupus). Un taux d’infection de l’ordre de 15 % a
été avancé, et la fréquence de l’infection augmente avec l’âge. Dans ce cas, les hôtes intermédiaires sont sans doute des
moutons ou d’autres ongulés.
Brucella spp. chez les mammifères marins
Depuis 1990 des chercheurs, en Europe comme aux Etats-Unis d’Amérique, ont isolé Brucella spp. chez diverses
espèces de mammifères marins. On a trouvé des preuves sérologiques de l’exposition à Brucella spp. chez des
mammifères marins échoués sur le rivage de l’Angleterre et du Pays de Galles, chez des baleines tuées à la chasse en
Norvège, et au cours d’opérations routinières de capture et de marquage aux Etats-Unis d'Amérique.
On a constaté que des marsouins (Phocoena phocoena), diverses espèces de dauphins et de baleines, ainsi que des
phoques, avaient été également exposés. Des isolats ont été obtenus à partir de sujets porteurs d'anticorps et l’on a
déterminé, par mise en culture, qu’il s’agissait d’espèces de Brucella. La détermination du type est en cours. Il est
probable que les isolats de Brucella obtenus à partir de mammifères marins constituent une nouvelle espèce.
La bactérie a été isolée de vers présents dans les poumons de plusieurs phoques par les laboratoires des Services
nationaux vétérinaires aux Etats-Unis d'Amérique. Cela donne à penser que ces helminthes pulmonaires pourraient
jouer un rôle dans la transmission de Brucella chez les phoques.
La brucellose chez le bison et les wapitis
L’éradication de la brucellose bovine chez les bovins domestiques et les bisons vivant dans les ranchs des Etats-Unis
d'Amérique est prévue d’ici à la fin de 1998. A l’heure actuelle, 26 troupeaux domestiques sont affectés dans cinq
Etats. Le seul foyer connu de brucellose subsistant aux Etats-Unis d'Amérique concerne les bisons sauvages (Bison
bison) et les wapitis (Cervus elaphus canadensis) dans le grand Domaine de Yellowstone (GYA) dans les Etats du
Montana, du Wyoming et de l’Idaho. On s’est préoccupé de la présence éventuelle de la brucellose chez les bisons du
Parc National de Yellowstone, mais le nombre de bisons s'étant échappé de Yellowstone avant 1988 était limité.
L’hiver dernier, la population du troupeau a atteint un chiffre record et le peu de fourrage existant au parc de
Yellowstone était recouvert de neige et de glace. Il s’en est suivi qu’un nombre accru de bisons a cherché de la
nourriture au-delà des limites du parc.
Afin de réduire le risque de brucellose, 1 079 bisons migrants ont été tués au fusil ou envoyés à l'abattoir pendant
l’hiver de 1996 à 1997. Environ 1 300 autres, ou plus, sont morts de faim à l’intérieur du parc. Les résultats d’études
pratiquées sur les bisons errants tués au cours de l’hiver ont mis en évidence, chez 49 % d’entre eux, la présence
d’anticorps dirigés contre Brucella abortus. On avait considéré, dans le passé, que les bisons domestiques étaient sans
doute à l’origine de la maladie dans les troupeaux de bovins infectés du Wyoming et du Dakota du Nord. En outre, les
wapitis ou les bisons sauvages du GYA ont été identifiés comme la source d’infection la plus probable de cinq autres
troupeaux de bovins. Plus récemment, les wapitis infectés ont été considérés comme la cause la plus probable des maux
de garrot observés chez les chevaux du Wyoming. Les populations de bisons et de wapitis du GYA sont les seules
populations d’animaux sauvages des Etats-Unis d’Amérique dont on sait qu’elles ont été infectées par B. abortus. On
note la présence, au Canada, d’une infection du bison des bois dans le Parc National de l’Alberta et dans les Territoires
du Nord-Ouest.
Tuberculose aviaire
La tuberculose aviaire (mycobactériose) a été signalée en Finlande chez des faisans (Phasianus colchicus), des oies
naines (Anser erythropus), un grand-duc (Bubo bubo) et une chouette de l’Oural (Strix uralensis), en Norvège, chez un
autour des palombes (Accipiter gentilis) et une chouette hulotte (Strix aluco), enfin en Suède chez un autour, une
chouette de l’Oural, une hulotte, deux cerfs élaphes (Cervus elaphus), un daim (Dama dama) et un harle huppé
(Mergus serrator).
Choléra aviaire
Le choléra aviaire a été diagnostiqué aux Etats-Unis d’Amérique chez de nombreux oiseaux aquatiques (canards, oies,
grèbes, foulques, cygnes) au cours de l’année écoulée (avril 1996-juin 1997). L’infection a été confirmée ou suspectée
dans 18 zones de sept Etats (Californie, Iowa, Missouri, Nebraska, Nouveau-Mexique, Oregon, Texas). Deux mille
eiders (Somateria mollissima) sont morts de cette maladie au Danemark.
Maladie hémorragique virale du lapin

Maladies des animaux sauvages/oct. 97 5
Le Ministère de l’Agriculture de Nouvelle-Zélande a confirmé que la maladie hémorragique virale du lapin avait été
reconnue chez des lapins morts découverts dans une propriété de la zone de Cromwell de South Island et qu’elle s'était
largement répandue. On pense que la maladie aurait été introduite illégalement.
Tularémie
La tularémie affecte régulièrement les populations de rongeurs et de lièvres en Europe, en Asie septentrionale, et en
Amérique du Nord. La présence de cette maladie a été signalée en 1996 chez des lièvres européens (Lepus europaeus)
et divers lièvres variables (Lepus timidus) en Autriche (n=24), en France (n=57), en Finlande (n=24), en Suède (n=5) et
en Russie (région d’Astrakhan). Une épidémie a été rapportée chez l’homme en Estonie. En Italie, plusieurs lièvres ont
été importés de régions de Roumanie exemptes de tularémie, mais on a constaté que 18% d'entre eux possédaient des
anticorps sériques contre l'agent de la tularémie.
Entérite virale du canard
Aux Etats-Unis d’Amérique, le virus de la peste du canard a été isolé en avril et mai 1997 chez des canards sur deux
sites de Virginie. La maladie a été suspectée dans une région de Californie en mai 1996, et elle a été confirmée en
Pennsylvanie, en Virginie, et au Wisconsin en mai 1996.
Maladies ne figurant pas sur les listes A et B
Maladie hémorragique épizootique chez les ruminants sauvages
Des flambées de maladie hémorragique épizootique ont affecté les cervidés de plusieurs régions des Etats-Unis
d’Amérique. Les sérotypes 1 et 2 des virus de la maladie hémorragique épizootique (EHDV-1 et EHDV-2) ont été
isolés chez des cerfs de Virginie (Odocoilus virginianus) en 1996. Un seul de ces sérotypes (EHDV-1) a été isolé dans
les prélèvements effectués sur un cerf du Tennessee. EHDV-2 a été isolé chez des cerfs de l’Alabama, de l’Arkansas,
de l’Indiana, du Kentucky, du Maryland, du Missouri, de Virginie et de Virginie occidentale. L’enquête par
questionnaire sur la maladie hémorragique épizootique, effectuée en 1996, a mis en évidence la présence de quelques
cas d’une forme chronique de la maladie en Alabama, en Arkansas, en Géorgie, au Mississippi, ainsi qu’en Caroline du
Nord et du Sud. Des foyers ont été notés dans l’Illinois, en Indiana, au Kentucky, au Maryland, au Missouri, au
Montana, en Pennsylvanie, et au Dakota du Sud.
Gale sarcoptique
La gale provoquée par Sarcoptes scabei est l’un des principaux facteurs de mortalité dans de nombreuses populations
d’animaux sauvages du monde. On en trouvera un exemple dans la gale sarcoptique du renard roux (Vulpes vulpes) en
Europe. On rapporte chaque année de nombreuses morts en Autriche, en Finlande, en France, en Italie, en Scandinavie
et au Royaume-Uni. On croit savoir que la maladie serait à l'origine de la disparition du renard roux dans l’île danoise
de Bornholm, dans la mer Baltique méridionale.
La gale sarcoptique reste une maladie grave pour le chamois (Rupicapra rupicapra) et le bouquetin (Capra sp.) dans
les zones montagneuses de l’Europe méridionale. S’il est improbable qu’une épizootie massive entraîne l’extinction de
ces espèces, elle pourrait sérieusement limiter leurs populations. Dans certaines zones isolées, comme c’est le cas pour
diverses sierras, en Espagne, les moutons ou les chèvres domestiques atteints de gale pourraient transmettre le parasite à
leurs congénères sauvages. La gale sarcoptique pourrait alors entraîner l’extinction d’une population isolée particulière.
Plusieurs populations de bouquetins sont les derniers refuges d’une sous-espèce rare.
En Europe, la gale sarcoptique sévit parfois chez plusieurs autres espèces de mammifères, et notamment chez les
carnivores tels que les martres et les fouines (Martes sp.), les loups (Canis lupus) et une espèce introduite : le chien
viverrin (Nyctereutes procyonoides). Dans le nord de la Scandinavie et en Finlande, l'endémie de gale du renard
constitue un danger tout particulier pour le lynx (Felix lynx). Le renard étant une proie pour le lynx, des cas mortels de
gale sarcoptique sont fréquemment contractés par l'intermédiaire des renards infectés.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%