Croissance pondérale précoce et âge de survenue de la puberté »

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XV - n° 5 - mai 2011
152
dossier thématique
dossier thématique
La transition enfant-adolescent
Croissance pondérale précoce
et âge de survenue de la puberté
Weight gain in infancy and the timing of puberty
Jacques Beltrand*
•»
La restriction de croissance fœtale aboutissant à un petit poids
de naissance est un facteur favorisant le développement d’une
puberté avancée.
•»
Cette restriction de croissance fœtale est souvent suivie d’une
période de croissance accélérée survenant au cours des 2 premières
années de vie et qui serait le vrai facteur favorisant la survenue
d’une puberté avancée.
•»
Cette croissance fœtale accélérée favoriserait l’apparition de
modifi cations de la composition corporelle caractérisée par un
excès de masse grasse à prédominance tronculaire.
•»
Ces modifi cations de la composition corporelle s’accompagneraient
de l’augmentation de diff érentes hormones clés du métabolisme :
l’insuline, la leptine et les androgènes surrénaliens favorisant in fi ne
une puberté avancée.
•»
Les mécanismes moléculaires sous-jacents sont encore mal connus,
mais des modifications épigénétiques des gènes régulant le
métabolisme pourraient être impliquées. Elles surviendraient lors
de la vie fœtale ou au cours des premiers mois de vie.
Mots-clés : Puberté – Croissance précoce – Masse grasse – insulinorésistance
– Leptine – Androgènes surrénaliens – Restriction de croissance fœtale.
Keywords : Puberty – Early growth – Fat mass – Insulin resistance – Leptin
– Adrenal androgens – Fetal growth restriction.
*Unité d’endocrinologie,
diabétologie et
gynécologie pédiatrique,
hôpital Necker-Enfants
malades, Paris.
L
e rôle que jouerait la prise de poids pendant l’en-
fance dans l’avancée de la maturation pubertaire
est exploré depuis de nombreuses années(1). Les
enfants dont la puberté débute de façon avancée sont
souvent ceux ayant développé un surpoids pendant
l’enfance. J.M.Tanner, dès le milieu des années1950,
a rapporté ce phénomène, en montrant que l’âge du
pic de croissance statural pubertaire était d’autant plus
jeune que le rapport poids/taille était élevé. Des résul-
tats similaires ont ensuite été retrouvés dans di érentes
études épidémiologiques montrant des di érences
nettes d’indice de masse corporelle (IMC) entre les
enfants développant une puberté avancée et ceux
développant une puberté tardive. On pourrait d’abord
penser que le lien épidémiologique entre un gain de
masse grasse plus important pendant l’enfance et une
puberté avancée pourrait simplement être un re et de
l’e et d’une maturation plus précoce sur l’acquisition
péripubertaire de la masse grasse et de la masse maigre.
Cependant, de plus en plus de données montrent que
la croissance pondérale pendant les premières années,
voire pendant les premiers mois de vie, serait un réel
déterminant de l’âge de la puberté. La petite enfance
serait donc une période de la vie ou des modi cations
de l’environnement nutritionnel pourraient induire
ou “programmer” des modi cations de la croissance
et du développement pubertaire. Si les mécanismes
moléculaires restent mal compris, l’insulinorésistance
et le surpoids joueraient un rôle central dans l’induction
des modi cations hormonales a ectant l’initiation de
la puberté.
Infl uence de la période périnatale
sur la prise de poids précoce ( gure)
Depuis le milieu des années1980, de nombreuses
études épidémiologiques ont montré que les men-
surations de naissance influençaient la croissance
précoce(2). En e et, un petit poids et une maigreur
à la naissance favoriseraient un gain de poids précoce
modi ant la répartition et la quantité de masse grasse
et, plus tard dans la vie, le risque de développer une
obésité(3). Pour de nombreux chercheurs, cette asso-
ciation entre poids de naissance et risque d’obésité
serait le re et clinique d’un phénomène biologique,
la “programmation” pendant la vie fœtale du déve-
loppement ultérieur du tissu adipeux. Cependant, la
restriction de croissance fœtale aboutissant à un petit
poids de naissance est souvent suivie d’une période
de croissance accélérée, ou croissance de rattrapage,
et c’est cette croissance précoce accélérée qui pourrait
être le vrai facteur in uençant le risque d’obésité(4).
La croissance pendant les premiers mois de vie est lar-
Points forts

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XV - n° 5 - mai 2011
153
Croissance pondérale précoce et âge de survenue de la puberté
gement in uencée par l’environnement nutritionnel, et
une prise de poids rapide pendant les premiers mois
de vie pourrait être induite par un meilleur appétit et
par des concentrations plasmatiques plus élevées de
leptine, une hormone satiétogène, notamment chez
les enfants exposés à une restriction de croissance
fœtale(5). De plus, les laits maternisés, dont la densité
énergétique est plus élevée que celle du lait maternel,
pourraient aussi expliquer les di érences de prise de
poids entre les enfants allaités et les enfants nourris
au biberon.
Les études épidémiologiques réalisées dans des
cohortes d’ethnies di érentes ont bien montré que la
transition d’un petit poids de naissance à un IMC normal
entraîne des modi cations de la composition corpo-
relle : répartition de la masse grasse à prédominance
tronculaire avec excès de tissu adipeux viscéral(6).
Rôle de l’insulinorésistance
La prise de poids rapide pendant l’enfance et le déve-
loppement d’une adiposité tronculaire seraient associés
à l’apparition d’une insulinorésistance. Les di érentes
études réalisées chez des enfants ou de jeunes adultes
nés avec un petit poids de naissance ont bien montré
que la transition d’un état de maigreur à la naissance
à un poids normal ou à un surpoids pendant l’enfance
ou l’adolescence s’accompagnait d’un risque plus élevé
de développer des stigmates biologiques évocateurs
d’une insulinorésistance(7), qui peut-être détectable
dès la deuxième décennie de vie. De plus, chez les
jeunes adultes nés avec un petit poids de naissance,
cette insulinorésistance ne se retrouvait que chez les
sujets dont l’IMC était dans les limites supérieures de
la normale ou dans des valeurs élevées traduisant le
rôle déterminant joué par le gain de poids après la
naissance. Il est donc difficile dans de nombreuses
études de déterminer quel est, des mensurations de
naissance ou de la prise de poids pendant l’enfance,
le facteur contribuant directement à l’apparition de
l’insulinorésistance.
Ainsi, bien que les enfants nés avec un poids de nais-
sance élevé et restant en surpoids pendant l’enfance
présentent dans les études de cohortes un risque d’obé-
sité ultérieure, ce sont les enfants nés avec un petit
poids de naissance et ayant présenté une croissance
accélérée pendant l’enfance qui sont le plus à risque
de développer un excès de masse grasse, une adiposité
tronculaire et une insulinorésistance. Certaines études
ont même montré que des signes de diminution de la
sensibilité à l’insuline pouvaient être détectés dès l’âge
de 1 an chez ces nourrissons, alors même que leur IMC
restait inférieur à celui des enfants nés avec un poids de
naissance normal(8). Cela pourrait être dû à l’apparition,
dès la première année de vie, de modi cations de la
répartition de la masse grasse. Cette insulinorésistance
et ces modi cations de la répartition de la masse grasse
pourraient avoir des conséquences dans le pro l de
croissance ultérieur et dans l’initiation de la puberté.
Croissance staturale
et croissance pondérale
L’âge à la puberté est étroitement lié à la croissance
staturale précoce et à la maturation osseuse. La puberté
débute, en moyenne, lorsque l’âge osseux atteint
11,7ans chez le garçon et 11,1ans chez la lle. Le pro l
de croissance ultérieur pourrait être prédit à partir du
pro l de croissance pendant les 2premières années de
vie, une croissance pondérale accélérée pendant l’en-
fance étant hautement annonciatrice d’une croissance
staturale plus rapide, d’une maturation osseuse plus
précoce et donc d’une puberté avancée. Àl’inverse,
une mauvaise croissance infantile entraîne un retard
de croissance staturale et, dans les cas les plus sévères,
une diminution de la taille à l’âge adulte. Une étude
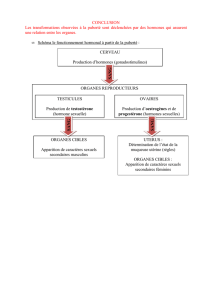
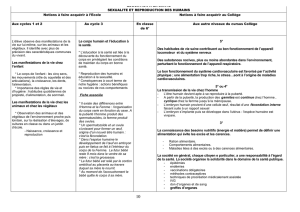
Figure. L’impact de l’environnement nutritionnel postnatal sur l’âge à la ménarche est in uencé
par l’environnement nutritionnel prénatal.
Chacune des 2lignes représente des sujets soit exposés à un environnement nutritionnel prénatal
optimal (ligne bleue), soit à un environnement nutritionnel prénatal délétère (ligne rouge). En
cas d’environnement nutritionnel postnatal riche (cadre vert), la période de restriction de crois-
sance fœtale va entraîner une avance encore plus marquée de l’âge de survenue de la puberté.
Environnement fœtal
optimal
Restriction de croissance
fœtale
Environnement
nutritionnel
pauvre
Environnement
nutritionnel
riche
Environnement nutritionnel pendant l’enfance
Âge à la ménarche

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XV - n° 5 - mai 2011
154
dossier thématique
dossier thématique
La transition enfant-adolescent
de cohorte anglaise a bien montré que la prise pon-
dérale rapide pendant les 2premières années de vie
était associée à une taille plus élevée à 8ans que celle
prédite par la taille cible génétique(9). De même, une
étude japonaise portant sur des variations séculaires
de la croissance a montré que si la taille de naissance
moyenne n’avait pas varié entre1950 et1990, à l’âge
de 2ans les enfants nés en1990 étaient en moyenne
plus grands de 4 cm que ceux nés en1950(10). De
plus, cette di érence de taille n’augmentait pas avec
les années, illustrant l’importance de la croissance dans
les 2premières années de vie dans le déterminisme
de la taille dé nitive. En réalité, nombreuses sont les
données illustrant le rôle majeur joué par la croissance
pondérale précoce dans le pro l de croissance ultérieur
et la maturation osseuse ainsi que le peu d’in uence à
long terme de la prise de poids pendant la deuxième
partie de l’enfance.
Les mécanismes par lesquels la prise de poids précoce
in uencerait le pro l de croissance staturale et l’âge à
la puberté restent spéculatifs. La croissance durant la
petite enfance est largement régulée par l’insuline et
l’IGF-1 (Insulin Growth Factor-1) alors que le rôle prédo-
minant de l’hormone de croissance ne devient évident
qu’après l’âge de 1an. L’IGF-1 est une hormone sécrétée
par le foie en réponse à l’activation des récepteurs à
l’hormone de croissance dont le nombre varie avec la
concentration plasmatique d’insuline. La croissance
pondérale rapide pendant la première année de vie,
et l’insulinorésistance qu’elle entraîne, pourrait donc
favoriser l’augmentation du nombre de récepteurs à
l’hormone de croissance et la sécrétion d’IGF-1 puis, in
ne, la croissance pondérale (11).
S’il est séduisant, ce modèle est cependant un peu
réducteur. En e et, de nombreuses autres hormones
(comme la leptine) pourraient voir leur sécrétion modi-
ée par la prise de poids précoce et seraient capables
d’in uencer la sécrétion de GnRH et donc le pro l de
croissance ultérieur puis l’âge d’initiation de la puberté.
Prise de poids
et développement pubertaire
Dès les années1970, il a été montré qu’il existait un
niveau critique de masse grasse au-dessous duquel un
développement pubertaire normal, et en particulier l’ap-
parition de cycles menstruels réguliers, ne pouvait avoir
lieu. Ainsi, un poids d’au moins 48kg et un pourcentage
de masse grasse d’au moins 22 % étaient nécessaires
pour permettre une apparition des menstruations(12).
Si ces résultats ont depuis été l’objet de controverses, la
découverte de la leptine dans les années1990 a permis
de trouver un candidat hormonal indiquant le niveau de
masse grasse au cerveau et pouvant agir sur la sécrétion
de gonadotrophines, des concentrations plus élevées
de leptine à la suite d’une croissance précoce rapide
pouvant être un déclencheur d’une puberté avancée.
La leptine est une hormone sécrétée par les adipocytes
et qui agit au niveau de l’hypothalamus pour réguler
l’appétit et l’homéostasie énergétique. Plusieurs études
animales ont mis en évidence que la leptine pourrait
être un facteur hormonal important pour l’initiation
de la puberté, et des études épidémiologiques ont
montré l’existence chez l’humain d’une augmentation
prépubertaire de la sécrétion de leptine. Si elle n’est pas
le facteur principal à l’origine du déclenchement de la
puberté, la leptine y joue probablement un rôle permis-
sif(13). Ce rôle a été con rmé à la fois chez les patients
ayant une mutation du récepteur de la leptine, chez
qui l’administration de leptine améliorait la pulsatilité
de sécrétion des gonadotrophines – uniquement pour
les sujets les plus proches de l’âge de la puberté –, et
chez des femmes atteintes d’aménorrhée secondaire
d’origine hypothalamique, pour qui l’administration de
leptine améliorait la pulsatilité de la sécrétion d’hor-
mone lutéinisante et le volume ovarien.
Une augmentation de la sécrétion d’androgènes sur-
rénaliens précède couramment la puberté. Ce phéno-
mène, indépendant de l’axe hypothalamo-hypohysaire
est cependant partiellement sous le contrôle de l’adré-
nocorticotrophine (ACTH). Des concentrations plus éle-
vées d’androgènes surrénaliens ont été observées chez
des enfants prépubères présentant un petit poids de
naissance ainsi qu’une croissance précoce accélérée. Le
rôle potentiel joué par l’augmentation de la sécrétion de
ces androgènes dans la survenue d’une puberté précoce
a bien été montré chez les sujets atteints d’hyperplasie
congénitale des surrénales. Un phénomène similaire
a été mis en évidence chez des jeunes lles nées avec
un petit poids de naissance, et le rôle central joué par
l’insulinorésistance a été con rmé lorsque ces sujets ont
été traités par de la metformine (un médicament amé-
liorant la sensibilité à l’insuline). Ce traitement diminuait
de façon signi cative la concentration plasmatique
d’hormones surrénaliennes et retardait l’apparition
de la puberté(14).
L’insulinorésistance et l’hyperinsulinémie compensatoire
qui s’y ajoute pourraient aussi réduire les concentrations
de la protéine porteuse des hormones sexuelles (Sex
Hormone-Binding Globulin [SHBG]). La SHBG régule la
biodisponibilité des hormones sexuelles et l’hyperinsu-
linémie pourrait donc l’augmenter(15). Chez des sujets
obèses ou en surpoids, cette augmentation, associée à

Croissance pondérale précoce et âge de survenue de la puberté
celle de la conversion des androgènes en œstrogènes
dans le tissu adipeux (liée à l’accroissement de l’activité
de l’aromatase du tissu adipeux), pourrait augmenter la
concentration d’hormones sexuelles libres et ainsi acti-
ver la sécrétion de gonadotrophines hypothalamiques.
L’augmentation des concentrations d’IGF-1 suivant
une période de prise de poids rapide joueraient aussi
un rôle dans la survenue d’une puberté avancée. Le
rôle éventuel de l’IGF-1 dans l’initiation de la puberté
a en e et été suggéré depuis de nombreuses années.
Si le lien de causalité direct n’est pas prouvé par toutes
ces études, la relation entre une prise de poids précoce,
des modi cations de la sensibilité à l’insuline et les
modi cations hormonales qui en découlent explique-
rait les di érences dans le risque de développer une
puberté avancée observée entre les lles et les garçons.
Le risque de puberté avancée est en e et plus élevé
chez les lles, qui ont tendance à avoir des concen-
trations plasmatiques d’insuline, d’IGF-1 et de leptine
plus élevées ainsi qu’une masse grasse plus importante
que celle des garçons. En cas de croissance précoce
accélérée, l’exacerbation de ces facteurs participerait
à l’apparition d’une puberté avancée de façon plus
fréquente chez les lles.
Déterminants génétiques
et épigénétiques de la prise de poids
infantile et de la puberté
La forte héritabilité de l’âge d’apparition de la puberté a
été largement démontrée. Une étude épidémiologique
récente a montré que la puberté avancée résultant
d’une prise de poids rapide pendant l’enfance était sus-
ceptible de se répéter dans les générations suivantes et
cela en l’absence de restriction de croissance fœtale. Cet
e et transgénérationnel serait la conséquence de modi-
cations épigénétiques des gènes contrôlant l’appétit
ou le développement du tissu adipeux survenant chez
le fœtus pendant la période de restriction de croissance
ou chez le nourrisson pendant la période de croissance
rapide. Il pourrait aussi être lié à une transmission plus
mendélienne de la prédisposition à une prise de poids
infantile plus rapide(16).
Conclusion
Les 2premières années de vie sont donc la période de
la vie au cours de laquelle des modi cations de la prise
de poids in uenceraient la croissance staturale et l’ini-
tiation de la puberté. Même si le lien direct de causalité
ne peut être a rmé, on peut proposer que l’apparition
d’une insulinorésistance dans les suites d’une restriction
de croissance fœtale puis d’une croissance pondérale
précoce accélérée joueraient un rôle majeur dans la
survenue d’une puberté précoce. Inversement, un poids
de naissance plus élevé ou une accélération de la crois-
sance pendant la deuxième partie de l’enfance auraient
l’un comme l’autre moins d’e ets sur l’âge d’apparition
de la puberté. Si les mécanismes liant insulinorésistance
et âge d’apparition de la puberté sont encore mal com-
pris, d’un point de vue évolutionnaire, la capacité de
l’organisme de l’enfant à ressentir la transition entre
un environnement nutritionnel prénatal délétère et
un environnement postnatal riche pourrait être avan-
tageuse. En e et, une croissance précoce rapide condui-
sant à une masse grasse plus importante (notamment
chez la lle) et à une maturation de la fonction sexuelle
plus précoce pourrait être une réponse adaptative de
l’organisme à la période de restriction de croissance
fœtale.
■
1. Tanner JM. Relation between age at puberty and adult
physique in man. J Physiol 1955;127(1):17P.
2. Barker DJ, Hales CN, Fall CH, Osmond C, Phipps K, Clark PM.
Type 2 (non-insulin-dependent) diabetes mellitus, hypertension
and hyperlipidaemia (syndrome X): relation to reduced fetal
growth. Diabetologia 1993;36(1):62-7.
3. Jaquet D, Deghmoun S, Chevenne D, Collin D, Czernichow
P, Lévy-Marchal C. Dynamic change in adiposity from fetal to
postnatal life is involved in the metabolic syndrome associated
with reduced fetal growth. Diabetologia 2005;48(5):849-55.
4. Ong KK, Ahmed ML, Emmett PM, Preece MA, Dunger DB.
Association between postnatal catch-up growth and obesity
in childhood: prospective cohort study. BMJ 2000;320(7240):
967-71.
5.
Ong KK, Ahmed ML, Sherriff A et al. Cord blood leptin is
associated with size at birth and predicts infancy weight
gain in humans. ALSPAC Study Team. Avon Longitudinal
Study of Pregnancy and Childhood. J Clin Endocrinol Metab
1999;84(3):1145-8.
6. Ibáñez L, Ong K, Dunger DB, de Zegher F. Early development
of adiposity and insulin resistance after catch-up weight gain
in small-for-gestational-age children. J Clin Endocrinol Metab
2006;91(6):2153-8.
7.
Ekelund U, Ong KK, Linné Y et al., Association of weight gain
in infancy and early childhood with metabolic risk in young
adults. J Clin Endocrinol Metab 2007;92(1):98-103.
8. Soto N, Bazaes RA, Peña V et al. Insulin sensitivity and secre-
tion are related to catch-up growth in small-for-gestational-
age infants at age 1 year: results from a prospective cohort. J
Clin Endocrinol Metab 2003;88(8):3645-50.
9. Dos Santos Silva I, De Stavola BL, Mann V, Kuh D, Hardy R,
Wadsworth ME. Prenatal factors, childhood growth trajecto-
ries and age at menarche. Int J Epidemiol 2002;31(2):405-12.
10. Cole TJ. The secular trend in human physical growth: a
biological view. Econ Hum Biol 2003;1(2):161-8.
11. Ong K, Kratzsch J, Kiess W, Dunger D;ALSPAC Study Team.
Circulating IGF-I levels in childhood are related to both cur-
rent body composition and early postnatal growth rate. J Clin
Endocrinol Metab 2002;87(3):1041-4.
12. Frisch RE, Revelle R. Height and weight at menarche and
a hypothesis of critical body weights and adolescent events.
Science 1970;169(943):397-9.
13. Cheung CC, Thornton JE, Kuijper JL, Weigle DS, Clifton DK,
Steiner RA. Leptin is a metabolic gate for the onset of puberty
in the female rat. Endocrinology 1997;138(2):855-8.
14.
Ibáñez L, Ong K, Valls C, Marcos MV, Dunger DB, de Zegher F.
Metformin treatment to prevent early puberty in girls with pre-
cocious pubarche. J Clin Endocrinol Metab 2006;91(8):2888-91.
15. Kalme T, Koistinen H, Loukovaara M, Koistinen R, Leinonen
P. Comparative studies on the regulation of insulin-like growth
factor-binding protein-1 (IGFBP-1) and sex hormone-binding
globulin (SHBG) production by insulin and insulin-like growth
factors in human hepatoma cells. J Steroid Biochem Mol Biol
2003;86(2):197-200.
16.
Cutfi eld WS, Hofman PL, Mitchell M, Morison IM. Could
epigenetics play a role in the developmental origins of health
and disease? Pediatr Res 2007;61(5 Pt 2):68R-75R.
R é f é r e n c e s
1
/
4
100%