Gélose XLT4

1/5
Biokar Diagnostics – Rue des Quarante Mines – ZAC de Ther – Allonne – B.P. 10245 – F60002 Beauvais Cedex – France
Tél : + 33 (0)3 44 14 33 33 – Fax : + 33 (0)3 44 14 33 34 – www.biokar-diagnostics.fr
Gélose XLT4
DOMAINE D’UTILISATION
La gélose XLT4 (Xylose-Lysine-Tergitol 4) est un milieu d’isolement utilisé pour la recherche des
Salmonella, à l’exception de Salmonella Typhi et Paratyphi, notamment chez les mammifères.
HISTORIQUE
En 1991, Miller et Tate démontrèrent que l’utilisation de la gélose Xylose Lysine Tergitol 4 (XLT4)
augmentait la fréquence de détection des Salmonella non-Typhi à partir de prélèvements d’origine
avicole contenant une microflore secondaire importante, et que le milieu permettait une bonne
différenciation entre Salmonella et Citrobacter. Le milieu décrit par ces auteurs incorporait le Tergitol
4 dans une base Xylose Lysine, modifiée pour inhiber un grand nombre de microorganismes
(Proteus, Pseudomonas, Providencia) qui interféraient auparavant sur la détection des Salmonella.
Des études ultérieures réalisées par Dusch et Altwegg établirent que le milieu XLT4 pouvait être
employé pour la recherche des Salmonella, à l’exception de Salmonella Typhi et Paratyphi, dans les
prélèvements cliniques.
PRINCIPES
- Le Tergitol 4 inhibe la croissance de la flore contaminante à Gram positif et de nombreux
microorganismes à Gram négatif, notamment les Proteus.
- Le xylose est fermenté par les germes entéropathogènes, à l’exception des Shigella qui sont
ainsi différenciées des autres bactéries. Après avoir utilisé le xylose, les salmonelles
décarboxylent la lysine (par l’intermédiaire de leur lysine-décarboxylase) en cadavérine, ce qui
provoque une augmentation de pH. En milieu devenu alcalin, les colonies de salmonelles
deviennent rouges en présence de l’indicateur de pH, le rouge de phénol.
- La réduction du citrate ferrique ammoniacal par les germes pathogènes producteurs de sulfure
d'hydrogène se manifestent par un noircissement qui est dû à l’apparition de sulfure de fer au
centre des colonies.
- Le milieu contient deux autres glucides : le lactose et le saccharose. La fermentation de l’un ou
l’autre ou des deux se traduit par une acidification du milieu, provoquant l’apparition de colonies
jaunes par virage du rouge de phénol.
- Les germes non pathogènes qui ne décarboxylent pas la lysine produisent une acidification
résultant des fermentations sucrées. L’abaissement de pH s’oppose au noircissement des
colonies.

2/5
Biokar Diagnostics – Rue des Quarante Mines – ZAC de Ther – Allonne – B.P. 10245 – F60002 Beauvais Cedex – France
Tél : + 33 (0)3 44 14 33 33 – Fax : + 33 (0)3 44 14 33 34 – www.biokar-diagnostics.fr
PREPARATION
- Mettre en suspension 59,0 g de milieu de base déshydraté (BK156) dans 1 litre d’eau distillée ou
déminéralisée.
- Ajouter 4,6 mL de supplément sélectif Tergitol 4 (BS039).
- Porter lentement le milieu à ébullition sous agitation constante et l’y maintenir durant le temps
nécessaire à sa dissolution.
- Ne pas surchauffer.
- Ne pas autoclaver.
MODE D’EMPLOI
- Refroidir et maintenir le milieu à 44-47°C.
- Couler en boîtes de Petri stériles.
- Laisser solidifier sur une surface froide.
- Faire sécher les boîtes à l’étuve, couvercle entrouvert.
- A la surface des boîtes ainsi préparées ou du milieu pré-coulé (BM036) ramené préalablement à
température ambiante, ensemencer en stries l’inoculum, à partir des milieux d’enrichissement
utilisés pour la recherche des Salmonella.
- Transférer parallèlement l’inoculum sur un autre milieu d’isolement sélectif tel que COMPASS®
Salmonella Agar (BM066).
- Incuber à 37 (± 2)°C pendant 24 à 48 heures.
LECTURE
Les colonies de Salmonella typiques (H2S-positif) sont rouges à centre noir. Elles peuvent présenter
un halo jaune après 24 heures d’incubation. En cas d’incubation prolongée, les colonies deviennent
rouges à roses à centre noir ou entièrement noires. Les colonies de Salmonella H
2S-négatif
apparaissent rouges à roses, sans centre noir.
Les Citrobacter, Klebsiella et Enterobacter cloacae produisent des colonies jaunes.
La croissance d’Enterobacter aerogenes et Escherichia coli est partiellement inhibée; les colonies
présentes sont de couleur jaune.
Proteus, Pseudomonas, Providencia sont partiellement à complètement inhibées.
Shigella présente une faible croissance et produit des colonies roses.
FORMULE - TYPE du milieu complet
(pouvant être ajustée de façon à obtenir des performances optimales)
Pour 1 litre de milieu :
- Peptone............................................................................................1,6 g
- Extrait autolytique de levure.............................................................3,0 g
- L-Lysine ...........................................................................................5,0 g
- Lactose ............................................................................................7,5 g
- Saccharose......................................................................................7,5 g
- Xylose ............................................................................................3,75 g
- Chlorure de sodium..........................................................................5,0 g
- Thiosulfate de sodium......................................................................6,8 g
- Citrate ferrique ammoniacal.............................................................0,8 g
- Rouge de phénol.........................................................................80,0 mg
- Tergitol 4.......................................................................................4,6 mL
- Agar agar bactériologique..............................................................18,0 g
pH du milieu prêt-à-l’emploi à 25°C : 7,4 ± 0,2.

3/5
Biokar Diagnostics – Rue des Quarante Mines – ZAC de Ther – Allonne – B.P. 10245 – F60002 Beauvais Cedex – France
Tél : + 33 (0)3 44 14 33 33 – Fax : + 33 (0)3 44 14 33 34 – www.biokar-diagnostics.fr
CONTRÔLE QUALITE
- Milieu de base déshydraté : poudre rosâtre, fluide et homogène.
- Milieu préparé (complet) : gélose rouge orangé.
- Réponse culturale typique après 48 heures d’incubation à 37°C :
Microorganismes Croissance Caractéristiques
Salmonella Typhimurium ATCC® 14028
Salmonella Enteritidis CIP 82.97
Escherichia coli ATCC 25922
Enterococcus faecalis ATCC 29212
Staphylococcus aureus ATCC 25923
bonne, score 2
bonne, score 2
partiellement
inhibée, score 0-1
inhibée, score 0
inhibée, score 0
colonies rouges à centre noir
colonies rouges à centre noir
colonies jaunes
STOCKAGE / CONSERVATION
Milieu de base déshydraté (sans Tergitol 4) : 2-30°C.
- La date de péremption est mentionnée sur l’étiquette.
- Milieu complet préparé en boîtes, avec supplément : 15 jours à 2-8°C, à l’abri de la lumière
(à titre indicatif).
Supplément sélectif Tergitol 4 :
- Stocker entre 2 et 25°C, à l’abri de la lumière.
- La date de péremption est mentionnée sur l’étiquette.
Milieu complet pré-coulé en boîtes de Petri :
- Stocker entre 2 et 8°C, à l’abri de la lumière.
- La date de péremption est mentionnée sur l’ étiquette.
PRESENTATION Code
Milieu complet pré-coulé en boîtes de Petri (Ø 90 mm) :
- Coffret de 20 boîtes BM03608
Milieu de base déshydraté (sans Tergitol 4):
- Flacon de 500 g BK156HA
Supplément sélectif Tergitol 4 :
- Flacon de 50 mL BS03908

4/5
Biokar Diagnostics – Rue des Quarante Mines – ZAC de Ther – Allonne – B.P. 10245 – F60002 Beauvais Cedex – France
Tél : + 33 (0)3 44 14 33 33 – Fax : + 33 (0)3 44 14 33 34 – www.biokar-diagnostics.fr
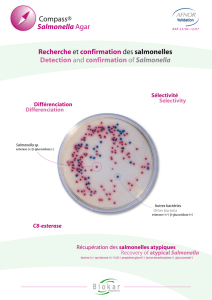
SUPPORT PHOTO :
Référence : [BK156HA + BS03908], BM03608
Domaine d’utilisation : Recherche des Salmonella, notamment chez les oiseaux et les
mammifères.
Gélose XLT4
Réf : BM03608
Incubation 24 heures à 37°C (surface)
Colonies caractéristiques rouges avec un précipité noir au centre (production de H2S);
les colonies deviennent totalement noires après incubation prolongée.
Salmonella
Typhimurium
Colonie caractéristique
Couleur rouge
à centre noir

5/5
Biokar Diagnostics – Rue des Quarante Mines – ZAC de Ther – Allonne – B.P. 10245 – F60002 Beauvais Cedex – France
Tél : + 33 (0)3 44 14 33 33 – Fax : + 33 (0)3 44 14 33 34 – www.biokar-diagnostics.fr
REFERENCES BIBLIOGRAPHIQUES
MILLER, R.G., TATE, C.R., MALLINSON, E.T., and SCHERRER, J.A.. 1991. Xylose-Lysine-Tergitol 4: An improved
selective agar medium for the isolation of Salmonella. Poultry Science, 70 : 2429-2432.
MILLER, R.G., TATE, C.R., MALLINSON, E.T., and SCHERRER, J.A.. Erratum. Xylose-Lysine-Tergitol 4: An improved
selective agar medium for the isolation of Salmonella. Poultry Science, 71 : 398.
TATE, C.R., MILLER, R.G., and MALLINSON E.T.. 1992. Evaluation of two isolation and two no-isolation methods for
detecting naturally occurring Salmonellae from broiler flock environmental drag-swab samples. Journal of Food Protection,
55 : 964-967.
DUSCH, H., and ALTWEGG, M.. 1995. Evaluation of five new plating media for isolation of Salmonella species. Journal of
Clinical Microbiology, 33 : 802-804.
WALLACE, H.A.. 1996. Evolution of Methods for the Detection of Salmonella in Foods. Journal of A.O.A.C. International,
79 : 4-12.
XP CEN ISO/TS 11133-2 (V 08-104-2). Janvier 2004. Microbiologie des aliments. Guide pour la préparation et la
production des milieux de culture. Partie 2 : Guide général pour les essais de performance des milieux de culture.
NF U 47-102. Janvier 2008. Méthodes d’analyse en santé animale. Isolement et identification de tout sérovar ou de
sérovar(s) spécifié(s) de salmonelles chez les mammifères.
COMPASS® est une marque de SOLABIA S.A.S..
Les mentions portées sur l’étiquette sont prédominantes sur les formules ou les instructions décrites dans ce document.
Les informations et les spécifications contenues dans cette fiche technique ont été établies à la date du 2009-06-04.
Elles sont susceptibles d’être modifiées à tout moment, sans préavis.
Code document : BK156/F/2003-03 : 9.
1
/
5
100%