? >

??
La Lettre du Cancérologue - Vol. XV - n° 6 - novembre 2006
3 questions à...
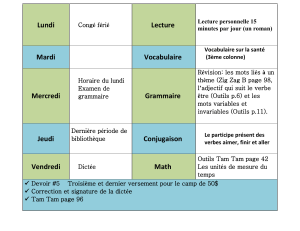
3questions à...
328
>
Quel est le bilan actuel des essais
de prévention du cancer du sein
avec le tamoxifène ?
Rappelons que le tamoxifène (tam) est un modulateur sélectif
des récepteurs des estrogènes (SERM) de type I. À ce jour, quatre
essais randomisés ont été conduits pour apprécier l’effi cacité de ce
composé pour réduire le risque de cancer du sein. Tous compa-
raient le tamoxifène (20 mg/j) pendant 5 ans à un placebo. Le plus
important, l’essai PI du NSABP, portait sur 13 388 femmes à “haut
risque de cancer du sein” : il s’agissait de femmes âgées de plus de
60 ans, ou de femmes entre 35 et 59 ans dont le risque de cancer du
sein calculé à l’aide du modèle de Gail était supérieur à 1,66 % sur
5 ans, ou de femmes présentant une hyperplasie atypique (HA) ou
un carcinome lobulaire in situ (CLIS). Deux études britanniques
incluaient des femmes à risque essentiellement familial, celle du
Royal Marsden (2 471 femmes), et l’essai IBIS 1 (7 152 femmes).
Enfi n, une étude italienne portait sur 5 408 femmes hystérec-
tomisées, sans que des facteurs de risque de cancer du sein ne
soient requis. Le risque de cancer du sein infi ltrant s’est révélé
signifi cativement réduit par le tamoxifène dans l’essai P1, RR :
0,51 (0,39-0,66), et dans l’essai IBIS 1, RR : 0,68 (0,50-0,92), mais
pas dans les deux autres études. Une méta-analyse des quatre
essais groupés a ensuite conclu à une réduction signifi cative de
38 % du risque de cancer du sein sous tamoxifène, avec un RR à
0,62 (0,42-0,89), donc d’une amplitude plus modérée que celle
retrouvée dans l’essai P1.
L’essai P1 a, par ailleurs, permis de préciser plus fi nement l’effi -
cacité préventive du tam : ce composé réduit le risque de cancer
infi ltrant hormonodépendant, mais non le risque de cancer ne
comportant pas de récepteurs des estrogènes.
Par ailleurs, il réduit de 50 % le risque de cancers in situ (p < 0,002).
Un point important concerne son effi cacité en cas de mastopa-
thie à très haut risque : la réduction du risque de cancer du sein
infi ltrant est observée en cas de CLIS, RR : 0,44 (0,16-1,06), et de
HA, RR : 0,14 (0,03-0,47).
L’essai P1 a également permis de préciser les autres eff ets du
tam : eff ets bénéfi ques tels que la réduction du risque de fractures
de hanche et de poignet, RR : 0,81 (0,63-1,05), mais aussi eff ets
délétères : parmi les plus ennuyeux, l’augmentation du risque de
cancer de l’endomètre, RR : 2,53 (1,35-4,97), d’accidents thrombo-
emboliques veineux, notamment d’embolie pulmonaire, RR : 3,01
(1,15-9,27), et de cataractes, RR : 1,14 (1,01-1,29).
Dans l’essai IBIS 1, il existait une augmentation signifi cative sous
tam du nombre de décès.
La mise en évidence de ces eff ets délétères amène donc à se poser
la question du rapport global des bénéfi ces et des risques du tam,
et a conduit certaines équipes à proposer des modèles d’analyse
de décision. En pratique, l’utilisation de tels modèles reste contro-
versée, d’une part, parce qu’ils s’appuient sur le modèle de Gail
pour la détermination du risque de cancer du sein (ce modèle
a une bonne valeur prédictive à l’échelon statistique, mais reste
diffi cilement applicable à l’individu en raison de son faible pouvoir
discriminant) et, d’autre part, en raison de l’absence de données
sur l’eff et du tam à long terme.
Aux États-Unis, la Food and Drug Administration approuve l’utili-
sation du tam chez les femmes dont le risque de cancer du sein sur
5 ans est égal ou supérieur à 1,66 % selon le modèle de Gail, mais
recommande une appréciation individuelle des bénéfi ces attendus
et des risques encourus par une telle prescription. Le bénéfi ce
attendu pourrait concerner les femmes à risque élevé de cancer du
sein, quel que soit leur âge, les femmes jeunes (moins susceptibles
d’avoir des eff ets indésirables), et les femmes hystérectomisées.
En France, le tam ne dispose pas d’une autorisation de mise sur
le marché (AMM) en prévention du cancer du sein.
Récemment, en 2005, a été publiée l’actualisation des résultats
de l’essai P1, avec 7 ans de suivi. Après la publication des résul-
tats initiaux en 1998, l’aveugle a été levé : les femmes du groupe
tamoxifène ont pu continuer à prendre ce composé pour une durée
totale de 5 ans. Les femmes du groupe placebo ont eu la possibilité
de commencer un traitement par tam, ou de participer à l’essai
STAR, qui comparait le raloxifène au tamoxifène chez des femmes
à risque de cancer du sein. En tout, 32 % des femmes du groupe
placebo ont accepté ces propositions. De ce fait, bien que les
résultats de l’étude actualisée soient intéressants, ils ne permettent
pas, comme le soulignent les auteurs, d’apprécier réellement les
eff ets du tamoxifène versus placebo stricto sensu. Cette publica-
tion confi rme la réduction du risque de cancer du sein infi ltrant
sous tam, RR : 0,57 (0,46-0,70), et de cancer du sein non invasif
RR : 0,63 (0,45-0,89). Elle confi rme également l’augmentation du
risque d’accidents tromboemboliques veineux et celle de cancer
de l’endomètre chez les femmes de plus de 50 ans.
>
Quels sont les résultats
des derniers essais avec les SERM,
et en particulier ceux de l’essai STAR ?
Le raloxifène est un SERM de 2e génération. Ses propriétés sur le
tissu osseux ont été à l’origine de l’essai multicentrique MORE,
qui comparait le raloxifène à la dose de 60 et de 120 mg/j à un
placebo chez 7 705 femmes ménopausées ostéoporotiques. Le
critère primaire de jugement était le risque de fracture ostéo-
porotique. L’évaluation du risque de cancer du sein constituait
un objectif secondaire. Cet essai a permis d’établir l’effi cacité du
raloxifène en prévention des fractures vertébrales, et a également
Entretien avec Pascale This (Institut Curie)
sur la chimio-prévention du cancer du sein
Pascale This on the chemoprevention of breast cancer

??
La Lettre du Cancérologue - Vol. XV - n° 6 - novembre 2006
3questions à...
329
3 questions à...
soulevé beaucoup d’espoirs : en eff et, après un suivi médian de
40 mois, on retrouvait une réduction du risque de cancer du sein
invasif chez les femmes sous raloxifène, RR : 0,24 (0,13-0,44),
et notamment de cancer du sein hormonodépendant, RR : 0,1
(0,04-0,24), soit une diminution de 90 %.
Cet effet favorable du raloxifène sur le risque de cancer du
sein a ensuite été confi rmé lors de la prolongation de l’étude
MORE, par l’étude CORE, portant sur un sous-groupe de plus
de 4 000 femmes de la cohorte MORE, suivies pendant 4 années
supplémentaires.
Cependant, il était diffi cile d’établir une conclusion ferme sur
l’eff et du raloxifène en prévention du cancer du sein, car l’étude
MORE n’avait pas été construite dans cet objectif.
De fait, l’essai STAR a été initié pour comparer l’effi cacité préven-
tive du tamoxifène et du raloxifène. Il s’agit d’un essai prospectif
randomisé en double aveugle, conduit en Amérique du Nord
et au Canada. Dix-neuf mille sept cent quarante-sept femmes
ménopausées ayant un risque de cancer du sein accru ont été
incluses. Leur âge moyen était de 58,5 ans, et leur risque moyen
de cancer du sein de 4,03 % à 5 ans. Elles ont reçu du tamoxifène
20 mg/j ou du raloxifène 60 mg/j. Notons que 19 % des femmes
avaient au moins deux antécédents de cancer du sein au 1
er
degré,
et plus de 71 % au moins un antécédent. Plus de 9 % avaient eu
une biopsie montrant un CLIS, et 22,5 % une HA.
Les résultats de cet essai viennent d’être récemment publiés avec
une durée moyenne de suivi de 3,9 ans, et une durée de traite-
ment de 3,1 ans. L’effi cacité préventive du raloxifène est en fait
équivalente à celle du tamoxifène, et non supérieure, RR : 1,20
(0,82-1,28). En revanche, on note moins de cancers du sein non
invasifs sous tam, RR : 1,40 (0,98-2,0). Ces deux composés ont
la même effi cacité chez les femmes ayant une HA ou un CLIS. Il
y a moins de cancers de l’utérus sous raloxifène, RR : 0,62 (0,35-
1,08), moins d’hyperplasies de l’endomètre, moins d’événements
thromboemboliques veineux, RR : 0,70 (0,54-0,91), et moins de
cataractes, RR : 0,79 (0,68-0,92). Les taux de fractures ostéoporo-
tiques, d’événements coronariens, d’accidents vasculaires céré-
braux, et la mortalité sont identiques dans les deux groupes.
Il s’agit donc de résultats “mitigés” : l’effi cacité préventive du
raloxifène est moins importante que ne le laissait espérer l’étude
MORE, mais ce composé semble avoir moins d’eff ets délétères
que le tam : bien que l’étude MORE ait montré que le raloxifène
augmente le risque thromboembolique veineux par rapport à un
placebo, cet eff et est moindre que celui du tam, et le raloxifène
n’augmente pas le risque de cancer de l’utérus. Concernant la
qualité de vie, les femmes sous tam présentent plus souvent des
problèmes gynécologiques, des symptômes vasomoteurs, des
crampes, et une incontinence urinaire. Sous raloxifène, on note
en revanche plus souvent des dyspareunies et une prise de poids.
Soulignons que ces diff érences étaient de faible amplitude.
En pratique, en France, le raloxifène dispose d’une AMM pour
le traitement et la prévention de l’ostéoporose à prédominance
vertébrale chez la femme ménopausée. Il est cependant prématuré
de le prescrire en prévention du cancer du sein, car des inter-
rogations demeurent, notamment sur la durée de prescription,
et sur les eff ets de ce composé à long terme.
>
Quelles sont les nouvelles approches
actuellement en cours avec les inhibiteurs de
l’aromatase ? Comment dé nir et sélectionner les
femmes “à risque” concernées par ces essais
de prévention ?
D’autres composés que les SERM sont également des candidats
potentiels pour la chimio-prévention du cancer du sein, notamment
les inhibiteurs de l’aromatase : rappelons que dans l’essai ATAC, qui
comparait la prise de tamoxifène à celle d’anastrozole ou à celle de
leur combinaison pendant cinq ans chez des femmes ménopausées
en traitement adjuvant d’un cancer du sein, on retrouvait un risque
de cancer du sein controlatéral plus faible sous anastrozole que
sous tam, RR : 0,42 (0,22-0,79), ce qui laissait espérer une effi cacité
encore supérieure en prévention du cancer du sein.
Plusieurs essais de chimio-prévention sont actuellement en cours :
l’essai IBIS 2, au Royaume-Uni, compare l’anastrozole à un placebo
chez des femmes à risque élevé de cancer du sein, et l’essai MAP 3,
aux États-Unis, compare l’aromasine à un placebo. Deux autres
essais concernent plus spécifi quement les femmes génétiquement
prédisposées : l’essai ApreS, en Italie, compare l’aromasine à un
placebo, et l’essai LIBER devrait commencer prochainement en
France, et comparera le létrozole à un placebo.
L’une des questions centrales qui reste posée est celle de la défi -
nition du profi l de risque des femmes susceptibles de se voir
proposer un traitement préventif. Les femmes porteuses d’une
mutation des gènes BRCA1 ou BRCA2, et celles chez qui des
biopsies ont mis en évidence une HA ou un CLIS peuvent être
clairement identifi ées, que ce soit sur la base d’une enquête géné-
tique, ou sur celle d’un examen anatomopathologique.
Il est, en revanche, plus diffi cile de cerner les candidates poten-
tielles à ces traitements préventifs parmi les femmes à risque fami-
lial plus modéré (lorsque les antécédents familiaux n’incitent pas à
eff ectuer une enquête génétique) ou lorsqu’une mutation délétère
n’a pu être identifi ée dans la famille. Diff érents modèles statistiques
sont actuellement à l’étude, pour défi nir, à partir d’une situa-
tion familiale donnée, la probabilité qu’une femme soit porteuse
d’une prédisposition génétique. Par ailleurs, pour déterminer le
niveau de risque de cancer du sein d’une femme en l’absence de
contexte familial, d’autres équipes tentent actuellement, dans le
même esprit que le modèle de Gail, de construire des modèles
statistiques intégrant, outre les facteurs de risque hormonaux
classiques, des facteurs d’individualisation plus récente, telle la
densité mammographique. Bien sûr, tous ces modèles devront
ensuite être validés dans les populations de femmes concernées. Il
faudra enfi n déterminer les seuils “de risque de cancer du sein” ou
de “probabilité de prédisposition” à partir desquels la prescription
d’un traitement préventif deviendra légitime.
Ainsi, pouvons-nous conclure que dans le domaine de la chimio-
prévention du cancer du sein, des interrogations notables demeurent
sur les composés utilisables, les femmes qui pourraient en bénéfi cier,
la durée idéale de prescription, les eff ets à long terme, et surtout
le rapport global des bénéfi ces et des risques de ces traitements.
Ce dernier point sera capital, puisqu’il s’agit de réduire le risque
de cancer du sein chez des femmes en bonne santé. N
1
/
2
100%