L’ M

MISE AU POINT
192
La Lettre du Cancérologue - Volume XIV - n° 4 - juillet-août 2005
L’
introduction des thérapies antirétrovirales a profon-
dément modifié la survie des patients infectés par
le virus de l’immunodéficience humaine (VIH). À
l’heure actuelle, on peut estimer à plusieurs dizaines d’années la
survie d’un patient dont l’infection par le VIH est contrôlée par
un traitement antiviral, c’est-à-dire s’accompagnant d’une indé-
tectabilité de la charge virale, et donc de la réplication virale plas-
matique, et d’une restauration immunitaire, avec des lympho-
cytes CD4 supérieurs à 250-300/mm3. La mise à disposition des
thérapeutiques antirétrovirales hautement actives (HAART) a
en effet, à partir de 1996, transformé durablement le pronostic
des patients infectés par le VIH, réduisant le nombre d’infections
opportunistes, leur gravité, le nombre de séjours à l’hôpital et la
mortalité générale liée au VIH (1).
Ainsi, la diminution drastique de la sévérité de l’infection VIH
et son corollaire, le vieillissement de la population infectée par
le VIH, ont conduit à l’émergence de comorbidités et d’autres
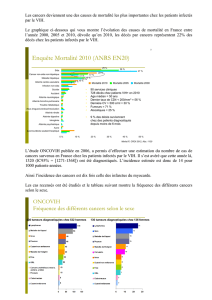
causes de mortalité. L’enquête intitulée “Mortalité 2000” (1),
dont l’objectif était la description de la répartition des causes de
décès en 2000 des adultes infectés par le VIH et de leurs carac-
téristiques, a nettement montré l’émergence de décès liés au virus
de l’hépatite C (VHC) et à des cancers non classant sida, ces décès
survenant avec un niveau d’immunodépression relativement peu
avancé.
Dans cette étude, sur un total de 964 décès, 269 (28 %) ont
été attribués à des cancers, dont 149 (15 %) étaient de type
classant.
Les lymphomes malins non hodgkiniens (LMNH), dont l’inci-
dence a diminué de façon moins importante que celle des infec-
tions opportunistes, ont été responsables de 11 % des décès
(105 cas), dont 27 lymphomes cérébraux primitifs. Le sarcome
de Kaposi a été responsable de 40 décès (4 %) et le cancer du
col utérin de 5 décès (0,5 %). Les cancers non associés au sida
ont été responsables de 120 décès (13 %), avec 103 tumeurs
solides (hépatocarcinome, cancers digestifs, cancer du canal
anal, cancer bronchique) et 17 hémopathies (maladie de
Hodgkin, leucémie myéloïde, myélome).
Les particularités les plus marquantes étaient la proportion impor-
tante de consommateurs excessifs d’alcool parmi les personnes
décédées du VHC, et de fumeurs parmi celles décédées de cancer,
cancer dont la localisation la plus fréquente était le poumon.
Comparées aux autres causes de décès, les tumeurs solides concer-
naient plus fréquemment des hommes, fumeurs, plus âgés et avec
un nombre absolu de lymphocytes CD4 plus élevé.
Les différents types de tumeurs malignes directement associées
à l’infection à VIH ont été largement décrits depuis le début de
l’épidémie : sarcome de Kaposi, LMNH de type B, lymphome
cérébral primitif et cancer du col utérin (2). Ces tumeurs malignes
partagent, sur le plan étiologique, la caractéristique d’être asso-
ciées et probablement causées par des virus à ADN, du groupe
herpès-EBV, HHV8, papillomavirus (HPV), dont la persistance
et le rôle oncogénique sont favorisés par l’immunodépression
cellulaire induite par le VIH.
De plus, les thérapeutiques antirétrovirales de type HAART ont
également eu un impact important sur l’histoire naturelle de ces
tumeurs malignes associées au VIH. Ainsi, l’incidence du sar-
come de Kaposi a considérablement diminué ; il en a été de même,
bien qu’à un moindre degré, pour les LMNH, comme cité pré-
cédemment.
De la même façon, l’histoire naturelle des LMNH a été modifiée.
Besson C. et al. (3) ont étudié l’incidence des lymphomes en
France chez des patients infectés par le VIH avant et après 1996,
date qui correspond au début des thérapies de type HAART. Entre
1993 et 1998, 145 cas de lymphomes ont été diagnostiqués dans
la base de données hospitalières française (FHDR), avec une inci-
dence nettement moindre de lymphomes associés au sida dans la
période post-HAART qu’à la période pré-HAART (42,9 ‰ ver-
sus 86 ‰ respectivement), y compris pour les lymphomes céré-
braux primitifs (9,7 ‰ versus 27,8 ‰ respectivement). La sur-
vie des patients a également augmenté d’une période à l’autre
(passant en moyenne de 6 à 20 mois ; p = 0,004). Ainsi, le pro-
nostic des patients atteints de LMNH associés au sida s’est amé-
lioré depuis l’utilisation des thérapies de type HAART. Cepen-
dant, les LMNH représentent en France la première cause de
mortalité chez les patients infectés par le VIH (3).
Avant les thérapeutiques de type HAART, les cancers non asso-
ciés au sida représentaient moins de 1 % des causes de décès dans
cette population (4-7), alors qu’ils représentent plus de 10 % des
causes de décès actuellement en France si l’on tient compte des
résultats de l’enquête de “Mortalité 2000” (1).
“Tumeurs malignes non opportunistes” et infection à VIH
Non-AIDS defining malignancies
●
J.P. Spano*, D. Costagliola**, C. Katlama***
* Département d’oncologie médicale, groupe hospitalier Pitié-Salpêtrière, Paris.
** Unité Inserm U720, université Pierre-et-Marie-Curie, Paris.
*** Département des maladies infectieuses, groupe hospitalier Pitié-Salpêtrière,
Paris.
.../...

193
La Lettre du Cancérologue - Volume XIV - n° 4 - juillet-août 2005
la période P1. L’incidence des cancers bronchiques a été plus éle-
vée pour les deux sexes durant la période P2.
L’ensemble des principales études épidémiologiques relatives aux
cancers non associés au VIH est résumé dans le tableau I (9-12).
Enfin, une dernière étude vient d’être publiée dans le Journal of
Cancer Institute, décrivant les cas de cancers chez des patients
infectés par le VIH, suivis en Suisse (13). Cette étude a eu pour
objet de déterminer si certains facteurs de risque (comme le
tabac), les traitements de type HAART ou certains groupes à
risque vis-à-vis de l’infection à VIH pouvaient expliquer l’aug-
mentation du risque de développer un cancer dans une cohorte
de patients suivis pour leur infection à VIH. Cette étude confirme
la diminution de l’incidence de la maladie de Kaposi, mais elle
montre aussi une diminution de l’incidence du cancer du col, et
non des LMNH, depuis le début des thérapies de type HAART
(période 1996-2002) chez les patients infectés par le VIH par rap-
port à la population générale. L’incidence est augmentée en
revanche pour quatre cancers non associés à l’infection par le VIH :
✓
le cancer bronchique (RR ajusté = 2,13 [IC95 : 1,06-4,27]) ;
✓
la maladie de Hodgkin (RR ajusté = 4,58 [IC95 : 3,10-6,77]) ;
✓
le cancer anorectal (RR ajusté = 10,13 [IC95 : 7,78-13,72]) ;
✓
le mélanome (RR ajusté = 2,99 [IC95 : 1,71-5,22]).
L’incidence des autres cancers habituellement décrits dans la popu-
lation générale, tels que le cancer du sein, le cancer du côlon et le
cancer de la prostate, n’a pas significativement augmenté chez les
patients suivis dans cette cohorte. Les thérapies de type HAART sem-
blent prévenir le risque de survenue de maladie de Kaposi et des
LMNH, conformément aux données de la littérature. Cependant, chez
ces patients traités par HAART, le risque de développer une maladie
de Hodgkin (en termes de risque relatif) est sensiblement comparable
à celui de développer une maladie de Kaposi et des LMNH, mais
il reste plus élevé pour la période post-HAART que pour la période
pré-HAART. Il n’a pas été démontré d’impact significatif des traite-
ments de type HAART sur l’incidence du cancer du col utérin. Quant
aux cancers du poumon, de la langue, de l’oropharynx ou du
pharynx, aucun cas n’a été observé chez les patients non fumeurs.
Tableau I.
Risque relatif de l’ensemble des cancers ne définissant pas le sida dans cinq études de patients atteints de sida.
Cohorte Date de l’étude Année de publication Nombre de sujets Nombre de cancers Risque relatif IC95
NCI AIDS Cancer 1985-1996 1998 98 226 712 1,7 1,5-2,3
Match
Grulich AE 1980-1993 1999 3 616 62 3,0 2,3-3,84
et al.
Gallagher B 1981-1994 2000 122 993 1 569 3,1 (hommes) 2,8-3,37
et al. 2,9 (femmes) 2,34-4,59
Frisch M. 1978-1996 2001 302 834 4 422 2,7 2,7-2,8
et al.
Herida M 1992-1995 2003 77 025 260 2,36 (hommes) 2,09-2,69
et al.
1996-1999 2003 77 025 260 1,91 (hommes) 1,71-2,13
1992-1995 2003 77 025 269 9,70 (femmes) 3,10-22,44
1996-1999 2003 77 025 269 14,29 (femmes) 6,84-26,27
.../...
L’augmentation importante de ces cas de tumeurs malignes peut
être attribuée à l’augmentation de l’espérance de vie des patients
infectés par le VIH, mais aussi au possible rôle oncogénique des
virus fréquemment associés au VIH, tels que l’hépatite B ou C,
le virus d’Epstein-Barr (EBV) et l’HPV, voire même au VIH lui-
même. Enfin, en plus de l’immunodépression évoluant depuis
plusieurs années, les déficits fonctionnels immunitaires qui exis-
tent dans le cadre de cette infection chronique à VIH pourraient
jouer un rôle physiopathologique dans la genèse de ces patholo-
gies malignes.
Plusieurs études épidémiologiques ont récemment montré par
rapport à la population générale une augmentation du risque pour
la maladie de Hodgkin (6, 7), le cancer bronchique (pour lequel
un tabagisme excessif est souvent retrouvé chez des patients
infectés par la VIH), certains cancers de la tête et du cou, le can-
cer du canal anal, les tumeurs du testicule, les cancers cutanés et
le mélanome (2-8).
Ces tumeurs malignes, non directement liées au VIH, sont carac-
térisées par une présentation clinique initiale plus agressive que
dans la population générale et une évolution clinique péjorative
semblant dépendre du statut immunitaire des patients au moment
du diagnostic. L’étude de Hérida M. et al. (7)a évalué l’incidence
des cancers non associés au sida chez des patients infectés par le
VIH au cours de deux périodes, la période P1 (1992-1995), pré-
HAART, et la période P2 (1996-1999), post-HAART. Les inci-
dences ont été comparées à celles de la population générale pour
le même âge et le même sexe. Le nombre de cancers diagnosti-
qués a été de 260 cas au cours de la période P1, et de 391 au cours
de la période P2, chez les 77 025 patients infectés par le VIH
suivis entre 1992 et 1999. L’incidence estimée pour tous les
cancers a été plus élevée chez les hommes durant les deux
périodes par rapport à celle retrouvée dans la population générale
(P1, standard incidence ration [SIR] = 2, 36 ; P2, SIR = 1, 91).
Seule l’incidence de la maladie de Hodgkin a été plus élevée que
dans la population générale pour les deux sexes et pour les deux
périodes, et plus élevée au cours de la période P2 qu’au cours de

MISE AU POINT
194
La Lettre du Cancérologue - Volume XIV - n° 4 - juillet-août 2005
On se propose ainsi, dans le cadre de cette revue, de présenter les
cas de tumeurs malignes non directement associées à l’infection à
VIH, les plus fréquemment rencontrées et qui représentent un nou-
veau défi dans la prise en charge des patients infectés par le VIH.
LA MALADIE DE HODGKIN
La maladie de Hodgkin (MH) représente la tumeur maligne la
plus fréquente parmi les cancers non associés à l’infection à VIH.
Le risque relatif de développer une MH chez les patients infec-
tés par le VIH varie, selon les études, de 5 à 50,9 (1-7) : ce risque
relatif a été de 23 et de 32 respectivement pour les périodes pré-
HAART et post-HAART chez les hommes, et de 10 et 14 chez
les femmes pour les mêmes périodes dans l’étude de Hérida M.
et al. (7). Si la plupart des études semblent suggérer que le risque
de MH augmente avec la durée de l’immunodéficience, l’étude
de Herida M. et al. (7) montre que l’incidence de la MH au cours
de la période post-HAART par rapport à la période pré-HAART,
avec un nombre de lymphocytes CD4 significativement plus élevé
et une proportion plus faible de patients au stade sida. Concer-
nant les caractéristiques clinicopathologiques communes à
l’ensemble des principales séries publiées dans la littérature sur
la MH (2, 6), on retrouve en général des formes plus agressives
de maladie, une fréquence plus importante de sous-types histo-
logiques de mauvais pronostic (type 3), des stades plus avancés
au moment du diagnostic et une évolution plus péjorative com-
parativement à la population générale. En effet, on observe dans
environ 75 % des cas des stades III et IV au moment du dia-
gnostic, associés fréquemment à une atteinte extra-ganglionnaire,
un envahissement de la moelle osseuse, une atteinte hépatique et
splénique. La MH survient en général à un stade précoce de
l’infection à VIH, chez des patients ayant un nombre absolu de
lymphocytes CD4 compris entre 275 et 305/mm3(2). Il est pro-
bable que l’augmentation de la survie des patients infectés par le
VIH, qui pourrait à l’avenir rendre classante sida cette maladie,
joue un rôle dans la pathogenèse de la MH ; sans oublier que
d’autres cofacteurs pourraient aussi être impliqués, comme une
co-infection par l’EBV (14). Il n’existe pas actuellement de traite-
ment optimal. En fonction du nombre de lymphocytes CD4 et de
la charge virale, les patients peuvent bénéficier des mêmes pro-
tocoles que les patients non infectés par le VIH. Le problème
majeur, au cours de ces traitements, reste les complications infec-
tieuses, qui peuvent être responsables de décès, et les complica-
tions hématologiques. Il est donc préférable d’utiliser des traite-
ments sous-dosés de type EBVP (épirubicine, bléomycine,
vinblastine, prednisone) chez les patients ayant des facteurs de
mauvais pronostic. De nouvelles combinaisons sont en cours
d’étude. En termes d’évolution, les rémissions cliniques sont rares
et les taux de rechute élevés, rendant la MH hautement respon-
sable de décès chez les patients infectés par le VIH (2, 6).
LE CANCER BRONCHIQUE
Il en est de même pour le cancer bronchique, dont les données
épidémiologiques convergent également vers une augmentation
de l’incidence chez les patients infectés par le VIH, sans pour
autant qu’il soit possible d’établir une éventuelle relation de cause
à effet. Cependant, un certain nombre de caractéristiques clinico-
pathologiques apparaissent différentes chez les patients infectés
par le VIH par rapport à la population générale, comme un âge
de survenue plus précoce, un tabagisme très important, une pré-
dominance des adénocarcinomes et surtout une présentation cli-
nique initiale plus avancée et un pronostic plus péjoratif (2, 8,
15-19) (tableau II). Au vu des études publiées à ce jour (8, 15-
19) le stade au moment du diagnostic ne semble pas corrélé au
nombre absolu de lymphocytes CD4. Cependant, plus de 70 %
des patients présentent un stade avancé de leur maladie au
moment du diagnostic (stades III et IV). Cette présentation,
d’emblée de mauvais pronostic, peut parfois être expliquée par
un retard au diagnostic, les étiologies infectieuses étant évoquées
en première intention devant une symptomatologie respiratoire
chez des patients infectés par le VIH. Sur le plan de l’évolution,
les principales études publiées sont concordantes et confirment
le caractère péjoratif du pronostic, avec des médianes de survie
comprises entre 1 et 8 mois (8, 15-19), la plupart des patients
décédant de progression tumorale.
Tableau II.
Principales caractéristiques clinicopathologiques des séries publiées de patients infectés par le VIH atteints de cancer bronchique.
Études J.P. Spano U. Tirelli J. Karp K.S. Sridhar R. Vyzula M.T. Alshafie
(15) (8) (16) (17) (18) (19)
N2236719 16 11
Âge médian 45 38 38 48 44,5 49,7
CD4 < 200/mm3(%) 9 28 – 53 54 30
Adénocarcinome 8 14 7 5 8 5
Carcinome épidermoïde 11 12 0 6 3 4
Carcinome à petites cellules 1 5 0 1 2 0
Carcinome à grandes cellules 1 5 0 2 3 1
Autres 1 _ 0 2 _ 1
Stades III-IV 16 26 7 15 13 10
Survie médiane (mois) 7 5 1 3 8 < 2

195
La Lettre du Cancérologue - Volume XIV - n° 4 - juillet-août 2005
Il n’existe pas à ce jour de recommandations thérapeutiques
spécifiques aux patients infectés par le VIH atteints de cancer
bronchique. Les patients doivent donc être traités de manière indi-
viduelle, en tenant compte de leur statut immunitaire, et confor-
mément aux recommandations proposées aux patients non infectés
par le VIH et atteints de cancer bronchique.
LE CANCER DU CANAL ANAL
Le cancer du canal anal présente chez les patients infectés par le
VIH des caractéristiques diagnostiques, thérapeutiques et pro-
nostiques différentes de celles observées chez les sujets non infec-
tés par le VIH. Il existe manifestement une augmentation de la
prévalence des cas de cancers du canal anal de type carcinome
épidermoïde, chez les hommes et les femmes infectés par le VIH
(20). Les tumeurs sont plus agressives, moins faciles à traiter,
avec une radio-chimiorésistance plus fréquente, d’où une fré-
quence plus élevée de récidive et d’échec du traitement. Cela sou-
ligne l’importance du dépistage des lésions dysplasiques de haut
grade et des cancers du canal anal à un stade très précoce. En
effet, comme pour le cancer du col utérin, le cancer du canal anal
est la plupart du temps précédé par des lésions prénéoplasiques
de différents grades (dysplasie de grades I, II et III), qui imposent
une surveillance spécifique aux patients infectés par le VIH (frot-
tis anal, anuscopie, biopsie) étant donné le haut risque de passage
à l’état invasif. Quant aux lésions de type fistules, fissures, hémor-
roïdes, elles ne font que faciliter l’accès du HPV aux couches basales
de l’épithélium (21).
En dépit des résultats des premières études rapportant l’effet
positif des HAART sur l’infection par HPV et les lésions pré-
néoplasiques de type dysplasie, les effets de ces thérapies anti-
rétrovirales sur le développement ou sur la régression de ces
lésions dysplasiques chez les patients VIH ne sont pas encore
clairement démontrés. L’effet des thérapies de type HAART sur
l’incidence des lésions prénéoplasiques bien connues pour les
lésions du col utérin n’est pas retrouvé chez toutes les équipes
(22). Dans une étude portant sur 45 hommes infectés par le VIH,
homosexuels et traités par HAART, 71 % présentaient des ano-
malies cytologiques du canal anal, 22 % avaient des lésions dys-
plasiques de haut grade et 42 % des lésions dysplasiques de bas
grade, et 80 % avaient une infection à HPV (23, 24). En dépit
d’un rétablissement de leur immunité sous HAART, la préva-
lence à la fois des lésions dysplasiques et du HPV est restée
inchangée (23). Récemment, des cas d’augmentation de cancer
du canal anal et de dysplasies ont même été rapportés chez des
patients infectés par le VIH, traités par HAART, alors que le
risque de survenue d’autres infections opportunistes avaient
diminué (25, 26). Actuellement, les arrêts des thérapies de type
HAART sont de plus en plus nécessaires chez les patients infec-
tés par le VIH. Il est donc indispensable de comprendre au mieux
les interactions entre le système immunitaire et l’évolution ou
l’apparition du processus tumoral. Des études longitudinales et
prospectives portant sur des patients infectés par HPV s’avèrent
nécessaires pour mieux évaluer le rôle des réponses immunes
dans le contrôle tumoral et la prédictibilité des facteurs virolo-
giques dans l’évolution de la maladie. L’enjeu thérapeutique,
dans ce cancer fréquent chez les patients infectés par le VIH, est
donc d’augmenter l’efficacité du traitement afin de contrôler des
tumeurs plus agressives, tout en diminuant les effets indésirables,
qui sont plus fréquents et plus importants que dans la popula-
tion générale (26). Des programmes de vaccination, de type pré-
ventif ou thérapeutique, vis-à-vis des lésions ano-génitales
induites par HPV sont également en cours de développement :
le principal objectif de ces programmes de vaccination est de
stimuler les réponses immunitaires induites par les lésions asso-
ciées à HPV, et ainsi d’augmenter les possibilités de régression
de ces mêmes lésions et d’éliminer la présence du virus (27).
Une meilleure connaissance du rôle des réponses immunes dans
l’histoire naturelle des pathologies associées à l’infection par
HPV chez les sujets non infectés et infectés par le VIH s’avère
donc nécessaire pour optimiser l’efficacité de ces nouvelles
approches préventives ou thérapeutiques.
LES CANCERS CUTANÉS (EN DEHORS DU MÉLANOME)
L’immunosuppression secondaire à une transplantation d’organe
ou à une greffe de moelle osseuse est depuis longtemps recon-
nue comme un facteur de risque de survenue de cancers cuta-
nés, en particulier de carcinomes de type spinocellulaire (28).
Chez les patients infectés par le VIH, les cancers cutanés les
plus fréquemment rencontrés sont la maladie de Kaposi, les car-
cinomes de type basocellulaire, avec également une tendance à
une plus grande fréquence des atteintes secondaires aux lym-
phomes ou d’autres cancers. En effet, comme pour les autres
pathologies non directement liées au VIH précédemment citées,
l’incidence des cancers cutanés chez les patients infectés par le
VIH semble plus importante par rapport à la population géné-
rale de même âge et de même sexe (9, 29), et, en dehors des
facteurs de risque connus comme l’exposition solaire ou des
antécédents familiaux, on retrouve fréquemment une infection
concomitante à HPV (30).
CAS PARTICULIER : LE MÉLANOME
Enfin, il a été rapporté un risque plus élevé de développer un
mélanome chez les patients immunodéprimés (2). Des cas ont été
rapportés chez des patients infectés par le VIH, montrant une pré-
pondérance de survenue chez les homosexuels, une invasion cuta-
née plus importante au moment du diagnostic, une présentation
clinique initiale le plus souvent métastatique, un nombre absolu
de CD4 bas et une évolution atypique, plus agressive, tous ces
éléments contribuant à un pronostic plus péjoratif.
AUTRES CANCERS
Un grand nombre d’autres tumeurs malignes a été rapporté chez les
patients infectés par le VIH. C’est le cas des tumeurs germinales
malignes, survenant habituellement chez des sujets jeunes. Il n’a
pas encore été démontré de relation de cause à effet entre les deux
affections, mais certaines études épidémiologiques ont d’ores et
déjà rapporté un risque de survenue estimé à 8,2 plus élevé que dans
la population générale de même âge et de même sexe (31). L’his-

MISE AU POINT
196
La Lettre du Cancérologue - Volume XIV - n° 4 - juillet-août 2005
toire naturelle de ces tumeurs germinales malignes ne semble pas
être influencée par l’infection à VIH et reste similaire à celle des
tumeurs retrouvées dans la population générale (31-33). En effet,
les chimiothérapies cytotoxiques standard ont pu être réalisées, asso-
ciées à une tolérance acceptable, et ont permis des taux de réponse
et des survies à 1 an comparables à ceux habituellement obtenus
chez les patients non infectés par le VIH. En termes de présenta-
tion clinique, approximativement 60 à 80 % des patients présentent
un stade I ou II au moment du diagnostic et 20 à 30 % seulement
présentent un stade III. La toxicité limitante reste la neutropénie
accompagnée de fièvre, sans majoration du risque de survenue
d’infections opportunistes. Ainsi, sur le plan thérapeutique, bien
que le nombre de données publiées reste faible, il semble que la chi-
miothérapie et la radiothérapie soient réalisables chez les patients
infectés par le VIH sans trop affecter le statut immunitaire des
patients. On peut espérer une survie sans récidive à long terme de
90 %.
La pathologie cancéreuse des voies aérodigestives a également été
décrite, mais de manière encore limitée, chez les patients infectés
par le VIH. Selon les données de l’étude américaine de Frisch M.
et al. (34), globalement, tous les cancers épithéliaux surviennent en
excès pendant la phase sida, par rapport à l’incidence attendue dans
la population générale. Les cancers oropharyngés amygdaliens sur-
viendraient plus fréquemment chez les hommes infectés par le VIH
que dans la population générale, le risque relatif étant de 2,6
(IC95 :1,8-3,8 ; n = 29). Les auteurs soulignent ainsi le fait que
l’exposition à des cofacteurs environnementaux tels que le taba-
gisme pourrait participer à la cancérogenèse liée à l’infection par
HPV. En effet, les auteurs finissent par conclure que les cancers
amygdaliens décrits chez de jeunes adultes de sexe masculin pour-
raient être en partie expliqués par l’association VIH-sida + carci-
nomes épithéliaux liés au HPV. Toutefois, l’aggravation de
l’immunosuppression ne semble pas s’accompagner d’une majo-
ration de l’incidence de ces cancers de la sphère ORL chez les
patients infectés par le VIH (2).
Bien que des cas de cancer du sein aient été décrits (35), il sem-
blerait que l’incidence du cancer du sein soit plus faible chez les
patientes infectées par le VIH que dans la population générale,
comme cela a été rapporté non seulement dans l’étude de Herida
M. et al. (7)mais également dans deux précédentes études menées
respectivement en Afrique et aux États-Unis (36, 37). Une des
hypothèses principales repose sur un nombre de données man-
quantes, mais certains auteurs semblent suggérer d’autres hypo-
thèses (faible milieu socio-économique, âge précoce du premier
enfant, forte parité et faible absorption d’alcool) (38). Par ailleurs,
cette faible incidence de cancer du sein a dores et déjà été rap-
portée chez les patients immunodéprimés par transplantation
d’organe (39).
Quant aux enfants infectés par le VIH, ce sont les myélosarcomes
qui ont surtout été rapportés dans la littérature, avec une fréquence
de survenue particulièrement élevée et des présentations plutôt
agressives par rapport à ce qui est retrouvé chez les enfants non
infectés par le VIH (40).
Au total, ces nouveaux types de cancers requièrent plus que
jamais une approche multidisciplinaire afin d’adapter au mieux
les options thérapeutiques appropriées.
TOLÉRANCE ET INTERACTIONS THÉRAPEUTIQUES
CHEZ LES PATIENTS INFECTÉS PAR LE VIH
De nombreuses questions restent en suspens tant en termes de
faisabilité que de tolérance en ce qui concerne les différents agents
cytotoxiques et les traitements antirétroviraux utilisés chez les
patients infectés par le VIH et atteints de pathologie maligne. Le
traitement des patients infectés par le VIH se complique souvent
et rapidement d’une toxicité médullaire secondaire au traitement
antirétroviral, anti-infectieux et de surcroît antimitotique, tous
ces traitements pouvant être administrés de manière concomi-
tante. L’utilisation de facteurs de croissance diminuerait ainsi la
morbidité chez ces patients de même que le risque de survenue
d’infections opportunistes, et pourrait améliorer la qualité de vie.
Pour les autres toxicités, elles rejoignent celles des traitements
standard et les toxicités propres à chaque drogue, avec parfois une
moins bonne tolérance digestive (nausées et/ou vomissements,
diarrhée) et cutanée (plus grande fréquence des surinfections fun-
giques, surtout si une radiothérapie externe est associée) [41].
Quant aux interactions entre les différents traitements, il est
important de souligner que les inhibiteurs de protéase et certains
inhibiteurs non nucléosidiques de transcriptase inverse parta-
gent la même voie métabolique. En effet, leur métabolisme
commun se fait via la famille du cytochrome (CYP34). Cette
voie concerne les anthracyclines, les alcaloïdes de la pervenche
et l’étoposide, mais aussi certains taxanes (paclitaxel) ou
encore le tamoxifène. Par conséquent, certaines associations
thérapeutiques pourraient être remises en cause (42).
Au total, pour mieux parer à l’immunosuppression induite par
la chimiothérapie antitumorale péjorative pour la réplication
virale, une combinaison avec un traitement antirétroviral doit
être envisagée. Pour le contrôle des infections opportunistes,
on se doit de discuter l’administration des traitements anti-
infectieux de prophylaxie tels que ceux habituellement utili-
sés contre la pneumocystose, la toxoplasmose, les mycobacté-
ries atypiques ou les mycoses digestives, étant donné l’absence
actuelle de recommandations concernant la prise en charge thé-
rapeutique des cancers associés à l’infection à VIH (43).
En conclusion, cette nouvelle approche nécessite l’intervention
et l’expertise d’oncologues, d’infectiologues et d’internistes ou
d’autres spécialistes concernés par la prise en charge de patients
infectés par le VIH. Ces nouvelles complications conduisent à
mettre en place des études épidémiologiques et biologiques des-
tinées à mieux comprendre la pathogenèse, le dépistage, l’évo-
lution et la prise en charge de ces pathologies malignes surve-
nant chez des patients infectés par le VIH.
C’est la raison pour laquelle un projet d’étude prospective (l’étude
ONCOVIH) va prochainement se mettre en place en France, ayant
pour but d’identifier les nouveaux cas de tumeurs malignes sur-
venant chez des personnes infectées par le VIH, de décrire la
typologie de ces pathologies malignes, leur prise en charge et leur
évolution sur une période de douze mois. Ces informations seront
essentielles pour mieux dépister et pour améliorer la prise en
charge de ces pathologies qui deviennent une cause de mortalité
fréquente chez les sujets infectés par le VIH. Le protocole ONCO-
VIH est disponible sur le site : www.ccde.chups.jussieu.fr.
■
 6
6
1
/
6
100%