Mise à jour sur les traitements de l`infertilité

WWW.PROFESSIONSANTE.CA – 27 FÉVRIER 2013 – L’ACTUALITÉ MÉDICALE – 47
MEDACTUEL DPC > MISE À JOUR SUR LES TRAITEMENTS DE L’INFERTILITÉ FÉMININE
L’Organisation mondiale de la san-
té reconnaît l’infertilité comme
une pathologie à part entière. L’in-
fertilité se définit par une absence
de conception après 12 mois ou
plus de rapports sexuels réguliers
non protégés1. Environ 8,5% des
couples canadiens en âge de pro-
créer ont un problème d’infertilité;
cette statistique concorde avec les
taux mondiaux2,3. Les causes de ce
problème sont variables. Elles
touchent autant l’homme (33% des
cas) que la femme (42%) et de-
meurent inexpliquées dans presque
15% des cas4. L’infertilité féminine
peut être due à une dysfonction
ovulatoire, une atteinte tubaire et
de l’endométriose. Le syndrome
des ovaires polykystiques (SOPK)
fait partie des dysfonctions ovula-
toires fréquentes touchant 5 à 10%
des femmes en âge de procréer1.
L’âge de la femme constitue un fac-
teur important dans l᾿infertilité fé-
minine. La fertilité féminine dimi-
nue progressivement dès 30 ans,
surtout entre 35 et 40 ans, et devient
presque nulle à 45 ans en raison de
l’appauvrissement de la réserve ova-
rienne et de la diminution de la qua-
lité des ovocytes5. C’est la raison pour
laquelle une évaluation et un traite-
ment correspondant peuvent parfois
être justifiés plus tôt, soit au bout de
six mois, ou d’emblée, sur la base des
antécédents médicaux et de l’âge de
la femme1.
La physiopathologie, l’étiologie et
le dépistage de l’infertilité ne seront
pas discutés dans cet article, mais
d’autres références médicales
peuvent être consultées afin d’obte-
nir plus d’information sur le su-
jet6,7. Cet article présente un aperçu
actualisé des traitements de l’infer-
tilité féminine.
PROGRAMME QUÉBÉCOIS DE
PROCRÉATION ASSISTÉE
Depuis août 2010, le gouvernement
québécois assume les frais relatifs
aux traitements de procréation as-
sistée, une première nord-améri-
caine. Les activités médicales sont
les suivantes: bilan de base d’infer-
tilité (féminin et masculin) et tests
complémentaires, don d’ovules,
prélèvement de sperme au moyen
d’une intervention médicale, congé-
lation du sperme et des ovules, pail-
lettes de sperme, fécondation in vi-
tro (FIV, soit trois cycles stimulés ou
six cycles naturels ou naturels mo-
difiés), diagnostic génétique préim-
plantatoire, transfert d’un embryon
frais ou congelé et congélation
d’embryons. Les médicaments sont
remboursés selon les modalités du
régime d’assurance médicament de
la patiente. Pour plus d’information
sur les modalités de couverture,
veuillez vous référer au site du mi-
nistère de la Santé et des Services so-
ciaux8. Ce programme vise à dimi-
nuer le nombre de grossesses
multiples fréquentes lors de ces trai-
tements. Les grossesses multiples
sont associées à plusieurs naissances
prématurées, lesquelles ont un im-
pact direct sur la morbidité et la
mortalité infantile9.
TRAITEMENTS UTILISÉS EN INFERTILITÉ
FÉMININE
Les grandes lignes de traitement en
infertilité féminine se divisent en
trois situations cliniques, soit l’in-
duction de l’ovulation (IO), l’insé-
mination intra-utérine (IIU) et la
FIV conventionnelle ou par la mi-
cro-injection (ICSI) (tableaux I et
II). Le choix des traitements de la
femme se fera en fonction des éva-
luations poussées des deux parte-
naires (examen physique, bilan
sanguin, spermogramme, hystéro-
salpingographie, tests endocri-
niens, etc.). L’objectif de l’IO
consiste à induire le recrutement
d’un ou deux follicules ovariens, à
provoquer leur maturation et la li-
bération d’un ou deux ovules au
maximum. La fécondation pourra
se faire naturellement (relations
sexuelles) ou par IIU, c’est-à-dire
par injection au fond de l’utérus
d’un échantillon de sperme lavé.
Enfin, la FIV consiste à stimuler les
ovaires au moyen d’hormones exo-
gènes afin de programmer la col-
lecte d’ovules, de faire féconder les
ovules et les spermatozoïdes en la-
boratoire et ainsi obtenir plusieurs
embryons dont l’un sera implanté
La faculté
de médecine
de l’Université Laval
Président du conseil
Dr François Croteau
Médecin de famille,
hôpi tal Santa-Cabrini,
Montréal;
Membre du Comité de
formation médicale
continue de Médecins
francophones du Canada;
Directeur médical du
Groupe Santé, Québec,
Rogers Média.
Dre Johanne Blais
Membre du Conseil de
FMC de la faculté de
médecine
de l’Université Laval;
Responsable du Comité
de FMC du dépt. de
médecine familiale de
l’Université Laval;
Professeur titulaire de
clinique, CHUQ, hôpital
Saint-François d’Assise.
Dr Roger Ladouceur
Responsable du Plan
d’autogestion de DPC,
Collège des médecins
du Québec;
Professeur agrégé de
clinique du dépt. de
médecine familiale
de l’Université de
Montréal;
Médecin de famille,
Hôpital de Verdun du
CSSS du Sud-Ouest-
Verdun.
Dre Francine Léger
Médecin de famille;
Professeur adjoint de
clinique au département
de médecine familiale de
l’Université de Montréal;
Service de périnatalité
du CHUM.
Dre Diane Poirier
Médecin, M.Sc.;
Chef du service des
soins intensifs au CSSS
Richelieu-Yamaska;
Professeur
d’enseignement clinique
au CHUS;
Membre du comité de
formation continue de
Médecins francophones
du Canada
Conseil de rédac tion
et révi sion scien ti fi que
Objectifs pédagogiques
◾ Comprendre la pharmacothérapie
utilisée en infertilité féminine.
◾ Reconnaître les principaux effets
indésirables.
◾ Conseiller un couple sur le
schéma thérapeutique prescrit.
DPC ET SPÉCIALITÉS
Mise à jour sur les traitements
de l’infertilité féminine
par Marie-Sophie Brochet1, Fanny David2, Carolina Marino3, Dr Élias Dahdouh4
Jeanne, 28 ans, débutera un protocole de FIV. Après avoir fait une investiga-
tion du couple, vous décidez de débuter un protocole à base de FSH
recombinante (75 UI die) et de cétrorélix (0,25 mg die). Votre patiente a
beaucoup lu sur le sujet. Elle trouve que les doses de FSH sont faibles. Elle
vous demande également le rôle du cétrorélix et son utilisation plus
tardive. Que lui répondrez-vous ? Quelques semaines après, elle vous
apprend qu’elle est enceinte et se demande si elle doit continuer l’applica-
tion de progestérone que vous lui avez prescrite à la suite du transfert
d’embryon.
CAS CLINIQUE
MedActuel DPC
VOTRE DÉVELOPPEMENT PROFESSIONNEL CONTINU VOL. 13 NO 2 27 FÉVRIER 2013
TABLEAU I
SITUATIONS CLINIQUES, INDICATION ET MÉDICAMENTS UTILISÉS
Situations cliniques Indication Médicaments utilisés Remarques
Induction de
l’ovulation (IO)
Dysfonction ovulatoire (aménorrhée/
oligoménorrhée, SOPK), insuffisance
lutéale, infertilité inexpliquée.
Clomifène ou létrozole ou
gonadotrophines
± hCG
± metformine
ovarien doit être fonctionnel.
Insémination
intra-utérine (IIU)
Échec de grossesse malgré ovulation,
infertilité masculine sévère à modérée,
infertilité inexpliquée, après échec
des traitements de première ligne.
Gonadotrophines ± hCG
± clomifène ou létrozole
parfois utilisé.
Fécondation in vitro
(FIV)
Infertilité tubaire, endométriose, infertilité
inexpliquée, infertilité masculine modérée
à sévère, réserve ovarienne diminuée.
Analogues de la GnRH
combinés parfois utilisés avant
de débuter un protocole avec
agoniste de la GnRH.
de débuter un protocole avec
antagoniste de la GnRH.
Gonadotrophines
hCG
Support de la phase lutéale
GnRH : Gonadolibérine ; hCG : Hormone gonadotrophique chorionique; SOPK : Syndrome des ovaires polykystiques
Affiliations des auteurs
1. B. Pharm, M.Sc., pharmacienne,
clinicienne associée, département
de pharmacie, membre actif du
Centre de procréation assistée, CHU
Sainte-Justine, Université de
Montréal
2. Assistante de recherche au moment
de la rédaction, département de
pharmacie, CHU Sainte-Justine,
Université de Montréal
3. Assistante de recherche au moment
de la rédaction, département de
pharmacie, CHU Sainte-Justine,
Université de Montréal
4. MD, Directeur médical du Centre de
procréation assistée, Département
d’obstétrique-gynécologie, CHU
Sainte-Justine, Université de
Montréal, Membre associé Procréa
Cliniques Montréal
Article révisé par le Dr Louis Granger,
professeur agrégé de clinique,
Département d’obstétrique-
gynécologie, CHU Sainte-Justine,
Université de Montréal, Membre
associé Procréa Cliniques Montréal
SUITE À LA PAGE 48 >

48 – L’ACTUALITÉ MÉDICALE – 27 FÉVRIER 2013 – WWW.PROFESSIONSANTE.CA
au niveau de l’utérus et les autres se-
ront cryoconservés.
INDUCTION DE L’OVULATION (IO)
> CLOMIFÈNE
Le clomifène représente le traite-
ment de premier recours pour l’in-
duction de l’ovulation, après les
changements de mode de vie (ali-
mentation, perte de poids, etc.). Il
bloque les récepteurs œstrogé-
niques au niveau de l’axe hypotha-
lamo-hypophysaire et provoque
ainsi une augmentation de la sécré-
tion de GnRH, FSH et LH. Ce pro-
cessus conduit au recrutement puis
à la maturation des follicules ova-
riens. L’effet anti-œstrogène du clo-
mifène peut toutefois altérer la qua-
lité du mucus cervical et amincir
l’endomètre, perturbant le proces-
sus d’implantation de l’embryon.
Ainsi, on observe un taux d’ovula-
tion de 80%, mais seulement 40-
45% de ces femmes auront un test
de grossesse positif10. L’axe hypo-
thalamo-hypophysaire devant être
fonctionnel, le clomifène n’est pas
indiqué chez les patientes avec hy-
perprolactinémie, anomalie de
l’axe hypothalamo-hypophysaire
ou en ménopause précoce11. Le trai-
tement est administré une fois par
jour durant cinq jours, et est géné-
ralement débuté les jours 3 ou 5 du
cycle. L’ovulation survient entre 6 et
12 jours après la fin du traitement6,7.
Une échographie ou le dosage de la
LH urinaire à partir du jour 10
pourront être effectués afin d’éva-
luer l’efficacité du clomifène et aus-
si afin de prévenir la survenue de
grossesses multiples dont l’inci-
dence est estimée à entre 15 et 30%.
Parmi les effets indésirables préoc-
cupants, des troubles visuels ont été
rapportés. La survenue est rare et
l’effet est réversible à l’arrêt du trai-
tement11. Une autre préoccupation
récemment mise en évidence est le
risque d’induire un cancer ovarien
ou utérin (surtout le type «border-
line»). Plusieurs éléments ne per-
mettent pas d’évaluer adéquate-
ment ce risque, les études publiées
étant rétrospectives, sur des petits
échantillons hétérogènes et les ré-
sultats étant rarement statistique-
ment significatifs. Deux études in-
diquent que l’effet sur l’endomètre
semble être cumulatif au fil des
cycles. Il est donc recommandé de
ne pas prolonger son utilisation au-
delà de 12 cycles12,13.
> LÉTROZOLE
Le létrozole est un inhibiteur de
l’aromatase, une enzyme respon-
sable de la synthèse des œstrogènes.
Elle empêche par conséquent la ré-
troaction négative par œstradiol
sur l’axe hypothalamo-hypophy-
saire et augmente ainsi la libération
de GnRH, FSH et LH. Contraire-
ment au clomifène, le létrozole ne
bloque pas les récepteurs œstrogé-
niques6,14,15. Les études révèlent
une incidence moindre d’effets in-
désirables, notamment au niveau
de l’endomètre, et un taux plus
faible de grossesses multiples, mais
des résultats comparables en termes
de grossesse14-16. Comme le citrate
de clomifène, il est administré en
général du jour 3 au jour 7. Son in-
nocuité chez les femmes enceintes
exposées au début du cycle a été cri-
tiquée à la suite de la publication de
l’étude de Biljan et coll. qui rappor-
tait une augmentation du risque
d’anomalies cardiaques et locomo-
trices dans un groupe de 150 nou-
veau-nés exposés in utero au létro-
zole seul ou combiné à des
gonadotrophines lorsque comparé
à des nouveau-nés non exposés17.
Trois études publiées par la suite
évaluant près de 900 expositions au
létrozole ne rapportaient pas d’aug-
mentation du risque de malforma-
tion majeure ni de patron d’anoma-
lie18-20. Son élimination rapide
exclut théoriquement une exposi-
tion possible durant l’organogé-
nèse. Malgré cela, le fabricant et
Santé Canada contre-indiquent
son utilisation en fertilité21.
> METFORMINE
La metformine peut être ajoutée au
clomifène chez les patientes avec ré-
sistance à cet agent, particulière-
ment dans le SOPK, chez les pa-
tientes plus âgées et celles avec un
IMC supérieur à 30 kg/m2 22. La
prise en charge des patientes avec
un SOPK a bien été décrite dans
d’autres références médicales22,23.
Deux méta-analyses et un essai
comparatif randomisé compilant
au total 1556 femmes avec un SOPK
indiquent que la metformine est ef-
ficace pour l’obtention d’une ovula-
tion par rapport au placebo, mais le
rapport de cote est significative-
ment supérieur lorsque cet agent
est combiné au clomifène24,25. Le
taux de grossesse est supérieur au
clomifène lors de l’utilisation
concomitante de ces deux agents25.
L’étude de Legro et coll. rapporte
également une hausse du taux de
naissance vivante avec cette com-
binaison par rapport à la metfor-
mine en monothérapie26. Des
études ont observé une réduction
du risque d’avortement spontané
lorsque la metformine est poursui-
vie durant le premier trimestre,
mais d’autres publications seraient
nécessaires27-30.
> LE « DRILLING OVARIEN
LAPAROSCOPIQUE »
Cette technique chirurgicale utili-
sée chez les patientes résistantes au
clomifène représente une alterna-
tive aux gonadotrophines parfois
utilisées en IO. Elle consiste à prati-
quer, sous vision directe, des micro
perforations au niveau des ovaires
par un électrocautère monopolaire
ou par laser. Le résultat possible est
la reprise transitoire de l’ovulation,
dans un délai moyen de six mois.
Typiquement, l’ovulation produite
est souvent mono-folliculaire sans
risque de syndrome d’hyperstimu-
lation ovarienne, ni de grossesses
multiples31. Des complications ont
toutefois été rapportées, notam-
ment, la formation d’adhérences
postopératoires et une diminution
de la réserve ovarienne32.
FÉCONDATION IN VITRO (FIV)
Plusieurs protocoles sont utilisés en
FIV. Le choix d’un protocole se fait
en considérant le profil de la pa-
tiente (par ex., âge, antécédents, ré-
ponse aux cycles précédents, ré-
serve ovarienne, etc.). Les principales
étapes sont les suivantes :
1. STIMULATION OVARIENNE
Des injections de gonadotrophines
(FSH et parfois LH) pendant 7 à
12jours vont stimuler le recrute-
ment et la maturation de multiples
follicules ovariens11. Les essais in-
diquent des taux de grossesse va-
riant entre 30 et 50 % selon l’âge de la
patiente (pour les moins de 38 ans).
Un taux de 25 à 35 % de grossesses
multiples a été rapporté. Ce risque
peut être diminué par le transfert sé-
lectif d’un seul embryon9.
2. INHIBITION DE L’ACTIVITÉ
OVARIENNE
a) Pour avoir un contrôle complet
de l’axe hypothalamo-hypophy-
saire, un analogue de la GnRH,
agoniste ou antagoniste, sera
ajouté dans le but de prévenir le
pic de LH et l’ovulation.
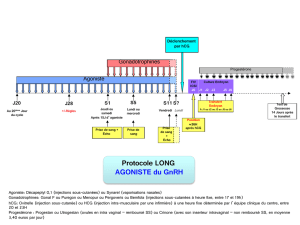
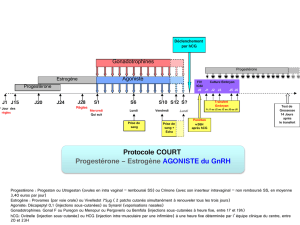
b) L’agoniste sera débuté au jour 21
du cycle antérieur (protocole
long) ou 2 jours avant (proto-
cole court) le début des gonado-
trophines (FSH et parfois LH).
c) L’antagoniste sera quant à lui dé-
buté après le début des gonado-
trophines soit le jour 5 ou 6 de
stimulation (protocole fixe), soit
lorsqu’un des follicules a un dia-
mètre > ou = à 14 mm (protocole
flexible)33.
d) Certains protocoles ajouteront
un contraceptif hormonal com-
biné 7 à 10 jours avant de débuter
la stimulation ovarienne.
3. MONITORAGE DE L’OVULATION
L’échographie (transvaginale) est
réalisée au tout début du cycle puis
répétée régulièrement durant le
cycle.
Elle consiste à évaluer la présence
de kystes ovariens, la réponse ova-
rienne par une observation de la
croissance folliculaire (taille,
nombre et répartition des folli-
cules) et à objectiver la réceptivité
endométriale.
Un dosage de l’œstradiol permet-
tra un suivi supplémentaire afin
d’évaluer la réponse au traitement.
D’autres dosages hormonaux
peuvent également être effectués se-
lon l’évolution (par ex., progestérone,
LH).
TABLEAU II
PRINCIPALES MOLÉCULES UTILISÉES EN INFERTILITÉ FÉMININE6,7,11-16,22,23,41,42,44-48,54-58
Nom
Formes pharmaceutiques Posologie Effets indésirables
Inducteurs de l’ovulation
Clomifène (Serophène, Clomid)
50 mg/comprimé
50 mg po die x 5 jours
S’il y a ovulation : même dose pour le cycle suivant (max 6 cycles)
S’il n’y a pas d’ovulation : ↑ 50 mg/jour à chaque cycle (max 150 mg/
dose et/ou 750 mg/cycle)
Effets anti-œstrogéniques (bouffées de chaleur, amincisse-
ment de l’endomètre, douleurs abdominales et pelviennes
changement d’humeur), symptômes visuels (diplopie, vision
floue), hypertrophie ovarienne, grossesses multiples
Létrozole (Femara)
2,5 mg/comprimé
2,5-7,5 mg po die x 5 jours Généralement bien toléré, troubles gastro-intestinaux (nau-
sées, vomissements, diarrhées)
Metformine (Glucophage)
500 et 850 mg/comprimé
500 mg po tid à 850 mg po bid (max 2 g/jour) pendant 6 à 12 cycles
Commencer à 250 à 500 mg po bid à tid
Augmenter graduellement selon la tolérance digestive
La durée de traitement peut aller jusqu’à 8 semaines de gestation
selon certaines études
Troubles gastro-intestinaux (nausées, vomissements,
diarrhées), acidose lactique (rare)
Gonadotrophines (Gn)
Ménotrophines urinaires (FSH/LH)
Repronex, Menopur3
Fiole1 75 UI FSH + 75 UI LH
IO :
Step-up conventionnel : 75 à 150 UI / j
Step-up low dose : 37,5 UI / j (↑ par paliers de 37,5 UI)
Step-down : 150 UI / j (↓ par paliers de 37,5 UI)
Protocole séquentiel (step-up / step-down)
FIV : 75-450 UI SC die (max 600 UI/jour)
Pour des doses > 450 UI, il est recommandé en pratique de diviser
la dose en 2 (soit une dose le matin et la balance le soir, toujours à la
même heure)
Débuter jour 3-4 du cycle selon protocole et selon le dosage
d’œstradiol et l’échographie
Des changements de dose sont possibles dans le même cycle en fonc-
tion de :
Durée 12 jours mais peut varier selon la réponse
Réaction/rougeur au site d’injection, mastalgie, nausées,
vomissements, diarrhée, douleur abdominale, céphalées,
SHSOa, grossesses multiples (dans le cadre d’IO)
Urofollitrophine (u-hFSH)
Bravelle3
Fiole1 75 UI
Follitropine α (r-FSH)
Gonal-F3
Cartouche2 300 UI, 450 UI, 900 UI
Fioles1 75 UI (unidose), 450 UI et 1050 UI
(multidose)
Follitropine β (r-FSH)
Puregon3
Cartouche2 300 UI, 600 UI, 900 UI
Fiole1 50 ou 100 UI
Lutropine α (r-LH)
Luveris
Fiole1 75 UI
75-150 UI SC die (max 225 UI/jour)
Voir commentaires FSH
Peut être mélangé à Gonal-F dans la même seringue
Gonadotrophine chorionique humaine (hCG)
hCG urinaire
hCG pour injection USP3
Pregnyl3
Fiole1 10 000 UI
Dose unique
hCG pour injection USP 5000 à 10 000 UI SC ou IM
Pregnyl : 5000 à 10 000 UI IM
Ovidrel : 250 µg SC
Céphalées, fatigue, irritabilité, SHSOa,
douleur au site d’injection, œdème (rare)
hCG recombinante (r-hCG)
Ovidrel3
Seringue2 250 µg
Fiole1 250 µg
> SUITE DE LA PAGE 47
MEDACTUEL DPC > MISE À JOUR SUR LES TRAITEMENTS DE L’INFERTILITÉ FÉMININE

WWW.PROFESSIONSANTE.CA – 27 FÉVRIER 2013 – L’ACTUALITÉ MÉDICALE – 49
4. DÉCLENCHEMENT DE L’OVULATION
L’administration d’une dose
unique d’hCG est programmée
après l’obtention d’un développe-
ment folliculaire adéquat
(>18mm) en réponse à la stimula-
tion ovarienne et en vue du prélè-
vement d’ovule avant la rupture
folliculaire. L’agoniste de la GnRH
est rarement une solution de re-
change à l’hCG lors d’un protocole
avec antagoniste11.
5. PONCTION OVARIENNE ET FIV
a) Réalisée 34 à 36 heures après l’in-
jection d’hCG, le prélèvement
d’ovules est effectué sous anes-
thésie locale et sédation11. Cette
intervention est effectuée à l’aide
d’une aiguille guidée par sonde
endovaginale. L’aiguille traverse
la paroi vaginale pour pénétrer
les ovaires où tous les follicules
seront ponctionnés. Les ovules
collectés et les spermatozoïdes
sont ensuite mis en contact in vi-
tro pour la fécondation.
b) Les complications associées à la
ponction sont rares. Un saigne-
ment vaginal modéré peut surve-
nir. Le risque infectieux est esti-
mé inférieur à 1%. La majorité
des centres ajoutent empirique-
ment une antibioprophylaxie
(par ex., azithromycine, doxycy-
cline). Une analgésie devrait être
prévue pour quelques jours.
6. SUPPORT DE LA PHASE LUTÉALE
La progestérone et parfois l’œstra-
diol sont ajoutés au protocole le len-
demain de la ponction ovarienne,
dans le but de mimer la phase lu-
téale et préparer l’endomètre à l’im-
plantation de l’embryon. Ces deux
agents seront poursuivis jusqu’à
huit semaines si la grossesse est
confirmée, mais cessés si le test de
grossesse est négatif.
7. TRANSFERT DE L’EMBRYON
L’embryon, placé dans des condi-
tions optimales de division cellu-
laire depuis la fécondation, est en-
suite transféré au niveau de
l’endomètre aux jours 3 à 5 après la
fécondation.
PRINCIPAUX MÉDICAMENTS
ADMINISTRÉS EN FIV
> ANALOGUES DE LA
GONADOLIBÉRINE (GNRH)
Il existe deux types d’analogues de
la GnRH, les agonistes et les anta-
gonistes. L’efficacité de chacun,
concernant les taux de grossesses et
de naissances vivantes, semble
comparable selon plusieurs
études34.
Les agonistes entraînent d’abord
un effet flare-up avec une stimula-
tion importante de la synthèse des
gonadotrophines, puis un blocage
apparaît, induisant une désensibili-
sation hypophysaire lorsque les ré-
cepteurs sont saturés. Les inconvé-
nients principaux liés à leur
utilisation sont le risque de déve-
lopper des kystes ovariens et des
symptômes de privation œstrogé-
nique à la suite de l’effet flare-
up35,36. Ces traitements sont longs
et coûteux. Le protocole «agoniste
long» reste toutefois largement uti-
lisé et permet une très bonne syn-
chronisation des follicules avec un
nombre élevé de follicules recru-
tés7,35,36.
Les antagonistes inhibent direc-
tement les récepteurs de la GnRH.
Leur emploi est plus récent et pré-
sente certains avantages. En effet,
leur action immédiate et réversible
dès l’arrêt confère une grande
flexibilité d’utilisation. Ils sont
mieux tolérés, sont donnés sur une
plus courte période (trois à six
jours par rapport à deux à quatre
semaines).
> GONADOTROPHINES (FSH, LH)
Les gonadotrophines permettent le
recrutement et la maturation des
follicules ovariens. Ils sont utilisés
en FIV et parfois en IO. Deux pro-
cédés de fabrication les caracté-
risent, soit d’origine urinaire et pu-
rifiée (femmes ménopausées), soit
obtenues par génie génétique (re-
combinante). Les résultats des es-
sais et de différentes méta-analyses
sont controversés quant à l’utilisa-
tion et l’efficacité des unes par rap-
port aux autres, mais il semblerait
que les praticiens aient recours pré-
férentiellement aux gonadotro-
phines recombinantes37-39. L’aju st e-
ment posologique est plus précis et
prévisible étant donné une moins
grande variabilité entre les lots. Ces
formulations présentent également
une incidence moindre d’hypersti-
mulation ovarienne. En revanche,
leur coût est bien supérieur et leur
tolérance semble similaire aux pro-
duits d’origine urinaire39.
> GONADOTROPHINE CHORIONIQUE
HUMAINE (HCG)
L’hCG, d’origine urinaire (femmes
enceintes) ou recombinante, a un
effet similaire à la LH. Toutes deux
possèdent la même chaîne bêta, se
fixent donc sur les mêmes récep-
teurs, mais l’hCG a une affinité six
à sept fois plus élevée et sa demi-vie
est beaucoup plus longue (24 heures
par rapport à 60minutes)7,39. Elle
permet de terminer la maturation
folliculaire et de déclencher l’ovula-
tion. Elle est toutefois considérée
comme un facteur déclenchant du
syndrome d’hyperstimulation ova-
rienne7,39. Par conséquent, un suivi
échographique et des dosages sé-
riques d’œstradiol sont nécessaires
avant de programmer son admi-
nistration.
>
Ces deux hormones stimulent et
régularisent la prolifération de l’en-
domètre40. Elles sont donc essen-
tielles au processus d’implantation
et à la poursuite de la grossesse
avant l’établissement du placenta41.
Le recours aux gonadotrophines,
aux agonistes de la GnRH, de
même que la ponction ovarienne
peuvent engendrer une insuffi-
sance de production de progesté-
rone et d’œstradiol endogènes lors
Nom
Formes pharmaceutiques Posologie Effets indésirables
Agonistes de GnRH
Buséréline
Suprefact
Fiole2 5,5 mg
Inhalation nasale 100 µg/inhalation
Lorsque les Gn sont débutées : 0,25 mg SC die
Lorsque les Gn sont débutées : 1 inh/narine 3 fois/jour
Doses et moment d’administration peuvent varier durant le cycle
selon le protocole
Au début : saignements vaginaux, douleur pelvienne,
kystes ovariens, réaction au site d’injection
Plus tard : bouffées de chaleurs, sécheresse vaginale,
céphalées, fatigue, altération de l’humeur
Leuprolide
Lupron
Fiole2 14mg
0,5 mg SC die
Lorsque les Gn sont débutées : 0,25 mg SC die
Max 1 mg/jour
Doses et moment d’administration peuvent varier durant le cycle
selon le protocole
Nafareline
Synarel
Inhalation nasale 200 µg/inhalation
Doses et moment d’administration peuvent varier durant le cycle
selon le protocole
Antagonistes de GnRH
Cétrorélix
Cetrotide3
Fiole1 0,25 mg, 3 mg
Débuter jour 5-6 du début des Gn et cesser le jour d’hCG
Min 12 h, max 30 h entre la dernière dose de 250 µg et l’hCG
Nausées, céphalées, saignements vaginaux, douleur pel-
vienne, réaction au site d’injection
Ganirelix
Orgalutran3
Seringue2 250 µg
Progestérone
Progestérone pour injection
Fiole2 50 mg/ml
50 mg IM die
-
tales
Attention, les capsules contiennent de l’huile
d’arachide, vérifiez les allergies aussi chez
le partenaire
Prometrium
Capsule micronisée 100 mg
200 mg intravaginale tid
Crinone3
Gel vaginal 8 %
1 application (90 mg) intravaginale die le matin
Endometrin3
Comprimés 100 mg
200-300 mg (2-3 comp.) intravaginale bid à tid
Œstrogènes
Estrace
Comprimés 0,5 mg, 1 mg, 2 mg
2 mg po bid-tid
Les doses peuvent varier selon les protocoles
Nausées, vomissements, céphalées, inconfort vaginal,
saignements, irritation cutanée au site du timbre
Climara3
Timbres 25, 50, 75, 100 µg
300 µg/semaine
Les doses peuvent varier selon les protocoles
FIV : fertilisation in vitro; Gn : Gonadotrophines; hCG : Hormone Chorionique Gonadotrophique; IM : voie intra-musculaire;
IO : Induction de l’ovulation; po : voie orale; SC : voie sous-cutanée; SHSO : Syndrome d’hyperstimulation ovarienne
1. Poudre lyophilisée pour reconstitution; 2. Solution pour injection; 3. Demande de médicament d’exception si la patiente est couverte par la RAMQ.
SUITE À LA PAGE 50 >
MEDACTUEL DPC > MISE À JOUR SUR LES TRAITEMENTS DE L’INFERTILITÉ FÉMININE

50 – L’ACTUALITÉ MÉDICALE – 27 FÉVRIER 2013 – WWW.PROFESSIONSANTE.CA
MEDACTUEL DPC > MISE À JOUR SUR LES TRAITEMENTS DE L’INFERTILITÉ FÉMININE
MEDACTUEL DPC > MISE À JOUR SUR LES TRAITEMENTS DE L’INFERTILITÉ FÉMININE
de la phase lutéale. L’endomètre est
donc moins favorable à l’implanta-
tion. L’œstradiol peut également
être utilisé pendant la phase de sti-
mulation ovarienne pour favoriser
l’action de l’antagoniste de la
GnRH, par sa rétroaction négative
sur l’axe hypothalamo-hypophy-
saire41. Il améliore la synchronisa-
tion de la croissance folliculaire, en
inhibant la sécrétion de GnRH et
de FSH entre les cycles, et favorise la
réponse ovarienne aux gonadotro-
phines.
> CONTRACEPTIFS HORMONAUX
COMBINÉS
Ils sont parfois utilisés en phase lu-
téale du cycle précédent, associés à
un protocole avec agoniste de la
GnRH dans le but de synchroniser
le développement folliculaire et
prévenir une libération spontanée
de LH, et également pour per-
mettre la dégénérescence du corps
jaune, restaurer la sensibilité ova-
rienne à la FSH et régulariser le
cycle43.
> ASPIRINE
À dose antiplaquettaire (≤ 150 mg/
jour), l’aspirine améliorerait la ré-
ceptivité de l’endomètre lors de
l’implantation en favorisant la per-
fusion utérine, mais des méta-ana-
lyses évaluant son impact sur le
nombre de grossesses cliniques,
d’avortements spontanés et de nais-
sances vivantes n’ont pu statistique-
ment prouver son efficacité44-47. En
pratique, on la débute à divers mo-
ments (le lendemain de la ponction
ovarienne ou du transfert d’em-
bryon, le premier jour de stimula-
tion avec les gonadotrophines, ou
au jour 21 du cycle précédent).
Quelques auteurs indiquent de ces-
ser l’aspirine à 10 semaines de ges-
tation45.
D'autres agents peuvent être utili-
sés en adjuvants (par ex., DHEA,
antibiothérapie, méthylpredniso-
lone, hormone de croissance). Leur
efficacité reste à prouver.
SYNDROME D’HYPERSTIMULATION
OVARIENNE (SHSO)
Complication directe de la FIV
pouvant rapidement évoluer en ur-
gence médicale, le SHSO comporte
plusieurs stades, allant de bénin à
critique. L’incidence de la forme bé-
nigne, qui a peu de conséquence
clinique, est de 20% à 33% et les
formes modérées et graves de 3 à
6% et 0,1 à 2% respectivement48-50.
Le SHSO combine une augmenta-
tion de la taille des ovaires à un
transfert de fluide intravasculaire
vers un troisième espace (périto-
néale, thoracique) et des phéno-
mènes thromboemboliques. Sa pa-
thophysiologie reste mal définie.
Elle semble impliquer une activa-
tion de la cascade de coagulation,
l’augmentation de la perméabilité
vasculaire par le biais du Vascular
Endothelial Growth Factor ainsi
que l’élévation rapide des niveaux
d’œstradiol, et impliquerait la pré-
sence de LH, d’hCG, d’IL-6 et IL-10
ainsi que l’activation du système ré-
nine-angiotensine-aldostérone48.
Les jeunes femmes (âge moyen de
27 ans), celles avec SOPK tout
comme celles avec antécédent de
SHSO sont plus susceptibles49,50.
La présentation clinique peut aller
de simples inconforts gastro-intes-
tinaux à une prise de poids rapide,
de l’oligo-anurie et de la dyspnée.
On observe au laboratoire une
faible leucocytémie, une forte
concentration d’albumine, une hé-
moconcentration, de la cytolyse hé-
patique, de l’hyponatrémie, hyper-
kaliémie. La taille des ovaires peut
atteindre plus de 12 cm et un épan-
chement pleural peut se présen-
ter49,50. Les symptômes peuvent
commencer à se manifester
24heures après l’administration
d’hCG, mais atteignent leur gravité
maximale 7 à 10 jours plus tard, soit
au moment correspondant à l’aug-
mentation endogène d’hCG si la
patiente est enceinte. Parmi les me-
sures préventives, citons le suivi ri-
goureux des échographies et des
taux d’œstradiol, le recours au pro-
tocole antagoniste, de petites doses
de gonadotrophines et d’hCG, ou
un agoniste de la GnRH pour dé-
clencher l’ovulation, l’annulation
du cycle, la diminution ou l’arrêt
des gonadotrophines48,51-53. <
1. ASRM, Definitions of infertility and
recurrent pregnancy loss. Fertil Steril,
2008. 90(5 Suppl): p. S60.
2. Elizabeth E, Puscheck, T.L.W. Infertility.
Medscape Reference. 2012 [06/05/2012];
http://emedicine.medscape.com/
article/274143-overview#aw2aab6b7.
3. Infertilité et procréation assistée. 25 mai
2011. www.ahrc-pac.gc.ca/v2/patients/
infertility-infertilite-fra.php (consulté le
10juillet 2012).
4. Maheshwari A. Effect of female age on the
diagnostic categories of infertility. Hum
Reprod 2008; 23(3): 538-42.
5. Mouzon de J, Allavena E, Scmitt C, Frappé M.
La fécondation in vitro en France. Approche
économique et influence du choix des
gonadotrophines (urinaires ou recombinantes)
sur le coût. Gynécologie obstétrique et fertilité,
2004. 32: p. 508-518.
6. Kahwati, J.E.C.M. Pour y voir plus clair
dans le traitement de l’infertilité. Québec
pharmacie, 2005. 52(5): p. 307-312.
7. Hardman J, M.W., ed. Infertility. ACCP.
PSAP. Women’s and Men’s Health. 6th ed.
2008.
8. Programme québécois de procréation
assisté. www.sante.gouv.qc.ca/
programmes-et-mesures-daide/
programme-quebecois-de-procreation-
assistee (consulté le 16 mai 2012).
Vous rassurez Jeanne quant au suivi de l’efficacité de ses médicaments.
Vous mentionnez l’importance de prévenir le SHSO (utilisation du protocole
antagoniste et augmentation progressive des doses). Vous lui enseignez
les symptômes à surveiller (gain de poids rapide et une augmentation de la
taille de l’abdomen, vomissements et diarrhées importants, diminution du
volume des urines, difficultés à respirer). Vous lui expliquez que le cétrorélix
permet d’obtenir un meilleur contrôle de son cycle et qu’il favorise une
meilleure maturation de ses follicules ovariens et évite une ovulation
précoce avant le prélèvement d’ovules. Vous lui dites que son action est
immédiate et qu’il peut être par conséquent utilisé au moment le plus
opportun. Vous lui mentionnez le rôle de la progestérone naturelle pendant
la grossesse et son intérêt dans les protocoles de FIV pour supplémenter la
phase lutéale et améliorer le taux de grossesse à terme.
RÉSOLUTION DU CAS CLINIQUE
> SUITE DE LA PAGE 49
CLASSIFICATION THÉRAPEUTIQUE :
Antispasmodique urinaire
INDICATIONS ET UTILISATION CLINIQUE : VESICARE
(succinate de solifénacine) est indiqué pour le traitement
de l’hyperactivité vésicale chez l’adulte qui présente des
symptômes d’incontinence urinaire par impériosités vésicales,
d'urgence mictionnelle et de pollakiurie.
Gériatrie : Lors d’études cliniques contrôlées par placebo,
une innocuité et une effi cacité similaires ont été observées
entre les patients âgés (623 patients ≥ 65 ans et 189 patients
≥ 75 ans) et les patients plus jeunes (1 188 patients < 65 ans)
traités au moyen de VESICARE.
Pédiatrie : L’innocuité et l'effi cacité chez l'enfant n'ont pas
encore été établies.
CONTRE-INDICATIONS
Patients qui souffrent de rétention urinaire, qui dépendent de
la dialyse, qui souffrent de gastroparésie ou d'un glaucome à
angle étroit. Patients qui sont hypersensibles à ce médicament,
à l'un ou l'autre des ingrédients de la préparation ou à un
élément de son contenant.
Populations particulières
Pour usage au sein des populations particulières, voir MISES EN
GARDE ET PRÉCAUTIONS, Populations particulières.
MISES EN GARDE ET PRÉCAUTIONS
Généralités : VESICARE, comme les autres médicaments
anticholinergiques, doit être administré avec prudence aux
patients qui ont de la diffi culté à transpirer afi n de réduire
le risque de prostration due à la chaleur et aux patients qui
présentent une obstruction vésicale en raison du risque de
rétention urinaire. VESICARE peut occasionner une vision
trouble. Les patients doivent être avisés de faire preuve de
circonspection s'ils doivent conduire ou opérer de la machinerie,
tant qu'ils n'auront pas déterminé l'effet du médicament sur
leur vision.
On a rapporté un œdème angioneurotique atteignant le
visage, les lèvres, la langue, ou le larynx avec la solifénacine.
Dans certains cas, l’angioedème a eu lieu après la première
dose. L’angioedème associé à l’enfl ure des voies respiratoires
supérieures peut mettre la vie en danger. Si la langue,
l’hypopharynx ou le larynx sont atteints, vous devriez
promptement cesser de prendre la solifénacine et un traitement
et/ou les mesures nécessaires devraient être prises afi n de
dégager les voies aériennes.
Une réaction anaphylactique a été rapportée chez certains
patients traités au VESICARE. Chez les patients développant
des réactions anaphylactiques, il faut immédiatement cesser le
traitement par VESICARE et un traitement et/ou les mesures
nécessaires devraient être prises afi n de dégager les voies
aériennes.
Surveillance et essais de laboratoire : Il peut être
approprié de vérifi er l'intervalle QT/QTc et/ou les taux
d'électrolytes sériques chez les patients à risque élevé qui
reçoivent VESICARE, tels que : les patients dont on sait qu'ils
présentent un allongement congénital ou acquis de l'intervalle
QT/QTc ou des troubles electrolytiques; les patients qui
prennent des médicaments ayant été associés à un allongement
de l'intervalle QT/QTc et/ou à la torsade de pointe, comme les
antiarythmiques de classe IA (p. ex., quinidine, procaïnamide)
ou de classe III (p. ex., amiodarone, sotalol), ou les patients qui
prennent de puissants inhibiteurs du CYP3A4.
Cardiovasculaire : Une étude sur l'effet de la solifénacine
sur l'intervalle QT a été effectuée auprès de 76 femmes en
bonne santé. L'effet sur l'allongement de l'intervalle QTc a
semblé plus grand avec la dose de 30 mg qu'avec la dose de
10 mg de solifénacine. Même si l'effet de la dose plus forte de
solifénacine (trois fois la dose thérapeutique maximum) étudiée
n'a pas semblé aussi marqué que celui de l’agent témoin
moxifl oxacine à sa dose thérapeutique, il y a eu recoupement
au niveau de l'intervalle de confi ance. Cette étude n'était pas
conçue pour effectuer une comparaison statistique directe entre
les médicaments ou entre les doses. Cette observation doit entrer
en ligne de compte lors de décisions cliniques concernant la
prescription de VESICARE à des patients qui ont des antécédents
avérés d'allongement du QT ou chez les patients qui prennent
des médicaments connus pour allonger l'intervalle QT. L'effet
de la solifénacine sur l'intervalle QTc chez les hommes n'a
pas fait l'objet d'études et la prudence s'impose lorsque l'on
extrapole les observations de cette étude aux patients de sexe
masculin. L'effet de la solifénacine sur l'intervalle QTc chez les
sujets âgés souffrant d'insuffi sance rénale occulte (chez qui la
concentration plasmatique de la solifénacine risque d'être plus
élevée que chez les sujets plus jeunes) n'a pas fait l'objet
d'études. L’allongement du QT et des torsades de pointes ont été
observés chez les patients présentant des facteurs de risques tels
le syndrome préexistant du QT long et l’hypokaliémie.
Gastro-intestinal : VESICARE, comme les autres
anticholinergiques, doit être utilisé avec prudence chez les
patients qui présentent un ralentissement de leur motilité
gastro-intestinale.
Hépatique : VESICARE doit être utilisé avec prudence chez
les patients qui présentent une fonction hépatique ralentie.
Les doses de VESICARE supérieures à 5 mg ne sont pas
recommandées chez les patients qui souffrent de dysfonction
hépatique modérée (Child-Pugh B). VESICARE n'est pas
recommandé chez les patients qui souffrent d'insuffi sance
hépatique grave (Child-Pugh C). (Voir POSOLOGIE ET
ADMINISTRATION et EFFETS INDÉSIRABLES).
Rénal : Utiliser avec prudence chez les patients qui souffrent
de dysfonction rénale. Les doses de VESICARE supérieures
à 5 mg ne sont pas recommandées chez les patients qui
souffrent d'insuffi sance rénale grave (CLcr < 30 mL/min). (Voir
POSOLOGIE ET ADMINISTRATION). VESICARE est contre-indiqué
chez les patients qui dépendent de la dialyse (voir CONTRE-
INDICATIONS).
Fonction sexuelle/reproduction : On ne dispose
d'aucune donnée clinique sur des femmes fertiles ayant
reçu un traitement prolongé par VESICARE. On ignore pour
l'instant à quel risque potentiel ces femmes sont exposées. Par
conséquent, VESICARE ne doit être utilisé durant la grossesse
que si les avantages escomptés pour la mère en justifi ent le
risque potentiel pour le foetus. Chez les femmes en âge de
procréer, le traitement ne peut être envisagé que si elles
utilisent une contraception adéquate.
Populations particulières
Femmes enceintes : Aucune étude pertinente et bien
contrôlée visant à évaluer les effets du succinate de solifénacine
auprès de femmes enceintes n'a été menée. Comme les études
de reproduction animale ne permettent pas toujours de prédire
la réponse humaine, VESICARE ne doit être administré à une
femme enceinte que si les bienfaits possibles justifi ent les
risques pour le foetus. Ce traitement peut être envisagé chez les
femmes en âge de procréer seulement si ces dernières utilisent
une méthode de contraception adéquate. L'effet de VESICARE
sur le travail et l'accouchement chez l'être humain n'a pas été
étudié.
Femmes qui allaitent : On ignore si la solifénacine est
excrétée dans le lait maternel chez l'être humain. Étant donné
que de nombreux médicaments le sont, VESICARE ne doit pas
être administré durant l'allaitement. Il faut décider soit de cesser
l'allaitement soit de cesser VESICARE chez les mères allaitantes.
EFFETS INDÉSIRABLES
Aperçu des effets indésirables du médicament : Les
effets indésirables prévisibles des agents antimuscariniques sont
la sécheresse de la bouche, la constipation, la vision trouble
(anomalies de l'accommodation), la rétention urinaire et la
sécheresse oculaire. Les effets indésirables les plus fréquents
signalés chez les patients traités par VESICARE ont été la
sécheresse de la bouche et la constipation, et l'incidence de
ces effets secondaires a été plus élevée dans le groupe traité
au moyen de 10 mg que dans le groupe traité au moyen de
5 mg. Comparativement aux douze semaines de traitement
par VESICARE, l'incidence et la gravité des effets indésirables
ont été similaires chez les patients qui ont continué de prendre
le médicament pendant une période allant jusqu'à 12 mois.
Au chapitre des effets indésirables, la raison la plus souvent
invoquée pour cesser le traitement a été la sécheresse de la
bouche, 1,5 %.
Pour signaler une réaction inattendue ou grave à ce
médicament, vous pouvez en faire mention à Santé Canada au
1 866 234-2345, ou à Astellas Pharma Canada, Inc. au
1 888 338-1824.
INTERACTIONS MÉDICAMENTEUSES
Aperçu : L'administration concomitante de ce produit
avec d'autres agents médicinaux dotés de propriétés
anticholinergiques pourrait donner lieu à des effets
thérapeutiques plus prononcés et à des réactions indésirables.
Un intervalle d'environ 1 semaine doit être prévu après
l'arrêt du traitement par VESICARE avant de débuter un
autre traitement anticholinergique. L'effet thérapeutique
de la solifénacine peut être atténué par l'administration
concomitante d'agonistes des récepteurs cholinergiques.
La solifénacine peut réduire l'effet des produits médicinaux
qui stimulent le motilité du tractus digestif, comme le
métoclopramide.
Médicaments métabolisés par le cytochrome P450 :
À des concentrations thérapeutiques, la solifénacine n'inhibe
pas les CYP1A1/2, 2C9, 2C19, 2D6 ni le 3A4 dérivés de
microsomes hépatiques humains.
Inhibiteurs du CYP3A4 : Des études sur le métabolisme
du médicament in vitro ont montré que la solifénacine est
un substrat du CYP3A4. Des inducteurs ou des inhibiteurs
du CYP3A4 peuvent modifi er la pharmacocinétique de la
solifénacine. Par conséquent, la dose de solifénacine doit
être maintenue ou ramenée à 5 mg par jour pendant que les
patients prennent un inhibiteur puissant du CYP3A4, comme le
kétoconazole, la clarithromycine, l'érythromycine, le diclofénac,
la néfazodone, le vérapamil et d’autres.
POSOLOGIE ET ADMINISTRATION
Considérations posologiques :
Modifications posologiques en présence
d'insuffi sance rénale : Chez les patients qui souffrent
d'insuffi sance rénale grave (CLcr < 30 mL/min), une dose
quotidienne de VESICARE supérieure à 5 mg n'est pas
recommandée. VESICARE est contre-indiqué chez les patients
qui dépendent de la dialyse (voir CONTRE-INDICATIONS).
Modifi cations posologiques en présence
d'insuffi sance hépatique : Chez les patients qui souffrent
de dysfonction hépatique modérée (Child-Pugh B), une
dose quotidienne de VESICARE supérieure à 5 mg n'est pas
recommandée. L'utilisation de VESICARE chez des patients qui
souffrent d'insuffi sance hépatique grave (Child-Pugh C) n'est
pas recommandée.
Modifi cations posologiques lors de l'administration
d'inhibiteurs du CYP3A4 : Lors de l’administration de
doses thérapeutiques de kétoconazole ou d'autres inhibiteurs
Résumé des renseignements
posologiques
Renseignements relatifs
à l’innocuité
Critères de sélection des patients
VE-2015-FP-PI-F1 Build #: F4 Date: Mar 16/12
Docket: ASVEX2015 Production Artist: DG
_____
________
Client: Astellas/Vesicare Art Director:
_____
________
Type Safety: 6.875" x 10" Copywriter: MM
_____
________
Trim Area: 7.875" x 10.75" Prod. Manager: TL
_____
________
Bleed: N/A Account Manager: WV
_____
________
Colour(s): B&W Studio Manager: GB
_____
________
NOTE: Margins: 0.50 (Sides)
0.375 (Top/Bottom)
Assoc. Creative Dir: MB
_____
________
Client:
____
____________
Administration
38204 VE-2015-FP-PI-1F_F4.indd 1 12-03-19 9:41 PM

WWW.PROFESSIONSANTE.CA – 27 FÉVRIER 2013 – L’ACTUALITÉ MÉDICALE – 51
35. Tarlatzis BC et Kolibianakis EM. GnRH
agonists vs antagonists. Best Pract Res Clin
Obstet Gynaecol 2007. 21(1): p. 57-65.
36. Depalo, R et al. GnRH agonist versus
GnRH antagonist in in vitro fertilization
and embryo transfer (IVF/ET). Reprod Biol
Endocrinol 10(1): p. 26.
37. Al-Inany H et al. Meta-analysis of
recombinant versus urinay-derived FSH:
an update. Human Reprod 2003. 18(2): p.
305-313.
38. Daya S et al. Recombinant vs urinary follicle
stimulating hormone for ovarian
stimulation in assisted reproduction.
Human Reprod 1999. 14: p. 2207-15.
39. ASRM, Gonadotropin preparations: past,
present, and future perspectives. Fertil Steril,
2008. 90(5 Suppl): p. S13-20.
40. Engmann L, DiLuigi A, Schmidt D,
Benadiva C, Maier D, Nulsen J. The effect of
luteal phase vaginal estradiol
supplementation on the success of in vitro
fertilization treatment: a prospective
randomized study. Fertil Steril. 2008
Mar;89(3):554-61. Epub 2007 Aug 2.
41. The Practice Committee of the American
Society for Reproductive Medicine in
collaboration with the Society for
Reproductive Endocrinology and Infertility.
Progesterone supplementation during the
luteal phase and in early pregnancy in the
treatment of infertility: an educational
bulletin. Fertil Steril 2008;5:S150-3.
42. Chang EM, Han JE, Won HJ, Kim YS,
Yoon TK, Lee WS. Effect of estrogen priming
through luteal phase and stimulation phase
in poor responders in in-vitro fertilization. J
Assist Reprod Genet. 2012 Mar;29(3):225-
30. Epub 2011 Dec 8.
43. Loutradis D, Vomvolaki E, Drakakis P. Poor
responder protocols for in-vitro fertilization:
options and results. Curr Opin Obstet
Gynecol. 2008 Aug;20(4):374-8.
44. Frattarelli JL, McWilliams GD, Hill MJ,
Miller KA, Scott RT Jr. Low-dose aspirin use
does not improve in vitro fertilization
outcomes in poor responders. Fertil Steril.
2008 May;89(5):1113-7. Epub 2007 Jul 5.
45. Groeneveld E, Broeze KA, Lambers MJ,
Haapsamo M, Dirckx K, Schoot BC, Salle
B, Duvan CI, Schats R, Mol BW, Hompes
PG; IPD MARIA study group. Is aspirin
effective in women undergoing in vitro
fertilization (IVF)? Results from an
individual patient data meta-analysis (IPD
MA). Hum Reprod Update 2011 Jul-
Aug;17(4):501-9. Epub 2011 Mar 21.
46. Gelbaya TA, Kyrgiou M, Li TC, Stern C,
Nardo LG. Low-dose aspirin for in vitro
fertilization: a systematic review and meta-
analysis. Hum Reprod Update. 2007 Jul-
Aug;13(4):357-64. Epub 2007 Mar 8.
47. Siristatidis CS. 2011. Aspirin for in vitro
fertilisation. Cochrane Database syst rev.
2011; Art. no. CD004832. DOI
10.1002/14651858. CD004832.pub3.
Human reprod update p. 233.
48. Lamazou F et al. Ovarian hyperstimulation
syndrome: pathophysiology, risk factors,
prevention, diagnosis and treatment. J
Gynecol Obstet Biol Reprod (Paris), 2011.
40(7): p. 593-611.
49. Shmorgun D et al. The diagnosis and
management of ovarian hyperstimulation
syndrome: No 268, November 2011. Int J
Gynaecol Obstet. 116(3): p. 268-73.
50. Doron Shmorgun D, Claman P. Diagnostic
et prise en charge du syndrome
d’hyperstimulation ovarienne, JOGC 2011;
268: S1-9.
51. Humaidan P, Quartarolo J, et Papanikolaou
EG. Preventing ovarian hyperstimulation
syndrome: guidance for the clinician. Fertil
Steril, 2010. 94(2): p. 389-400.
52. Papanikolaou EG et al. New algorithm for
OHSS prevention. Reprod Biol Endocrinol,
2011 (9): p. 147.
53. D’Angelo A, Brown J, et Amso NN. Coasting
(withholding gonadotrophins) for preventing
ovarian hyperstimulation syndrome.
Cochrane Database Syst Rev, 2011(6): p.
CD002811.
54. Association des pharmaciens du Canada.
Compendium des produits et spécialités
pharmaceutiques. Ottawa: Association des
pharmaciens du Canada, 2012.
55. Serono Canada inc. Nos produits (En ligne).
Adresse URL: www.serono-canada.com/
français/serono/products.htm
56. Homburg R, Howles CM. Low-dose FSH
therapy for anovulatory infertility associated
with polycystic ovary syndrome: rationale,
results, reflections and refinements. Hum
Reprod Update 1999 Sep-Oct: 493-9.
57. Christin-Maitre S, Hugues JN.
Recombinant FSH Study Group. A
comparative randomized multicentric study
comparing the step-up versus step-down
protocol in polycystic ovary syndrome. Hum
Reprod. 2003 Aug;18(8):1626-31.
58. Pharmaceutical Partners of Canada inc.
Monographie de hCG (Gonadotrophine
chorionique). Richmond Hill, Ontario,
Janvier 2008.
28. Nawaz FH, Khalid R, Naru T, Rizvi J. Does
continuous use of metformin throughout
pregnancy improve pregnancy outcomes in
women with polycystic ovarian syndrome? J
Obstet Gynaecol Res 2008 ; 34 : 832-7.
29. Sohrabvand F, Shariat M, Haghollahi F,
Bagheri B. Effect of metformin on
miscarriage in pregnant patients with
polycystic ovary syndrome. West Indian
Med J 2009; 58 : 433-6.
30. Thatcher SS, Jackson EM. Pregnancy
outcome in infertile patients with polycystic
ovary syndrome who were treated with
metformin. Fertil Steril 2006; 85 : 1002-9.
31. Fernandez H, Morin-Surruca M, Torre A,
Faivre E, Deffieux X, Gervaise A. Ovarian
drilling for surgical treatment of polycystic
ovarian syndrome: a comprehensive review.
Reprod Biomed Online 2011; 22(6): 556-68.
32. Mercorio F, Mercorio A, Di Spiezio Sardo
A, Barba GV, Pellicano M, Nappi C.
Evaluation of ovarian adhesion formation
after laparoscopic ovarian drilling by
second-look minilaparoscopy. Fertil Steril.
2008; 89(5): 1229-33.
33. Al-Inany et coll. Gonadotrophin-releasing
hormone antagonists for assisted
reproductive technology.
34. Susheil J et al. Optimal stimulation protocols
for in vitro fertilization. Fertility and sterility
2006. 86(2): 267-273.
avis/prof/_2005/femara_hpc-cps-fra.php
(consulté le 18 septembre 2012).
22. Vause TDR, Chueung AP et al.
Déclenchement de l’ovulation en présence du
syndrome des ovaires polykystiques. J Obstet
Gynecol Can 2010; 32(5): 503-11.
23. Croteau M, Bérubé J. Diagnostic et
traitement des ovaires polykystiques, êtes-
vous polyvalent? Le Médecin du Québec
2011; 46(3): 41-46.
24. Lord JM, Flight IHK, Norman RJ.
Metformin in polycystic ovary syndrome:
systematic review and meta-analysis. BMJ
2003; 327(7421): 951-3.
25. Creanga AA, Bradley HM, McCormick C,
Witkop CT. Use of metformin in polycystic
ovary syndrome: a meta-analysis. Obstet
Gynecol 2008 Apr: 959-68.
26. Legro RS, Barnhart HX, Schlaff WD, Carr
BR, Diamond MP, Carson SA, Steinkampf
MP, Coutifaris C, McGovern PG, Cataldo
NA, Gosman GG, Nestler JE, Giudice LC,
Leppert PC, Myers ER; Cooperative
Multicenter Reproductive Medicine
Network. Clomiphene, metformin, or both
for infertility in the polycystic ovary
syndrome. N Engl J Med 2007 Feb: 551-66.
27. Gilbert C, Valois M, Koren G. Pregnancy
outcome after first-trimester exposure to
metformin: a meta-analysis. Fertil Steril
2006 ; 86 : 658-63.
clomiphene citrate as first line for
anovulatory infertility: a debate. Reprod
Biol Endocrinol. 9: p. 86.
17. Biljan MM, Hemmings R, Brassard N. The
outcome of 150 babies following the
treatment with letrozole or letrozole and
gonadotropins. Fertil Steril 2005; 84
(supp.1); O-231, Abstract 1033.
18. Tulandi T, Martin J, Al-Fadhli R, Kabli N,
Forman R, Hitkari J, Librach C, Greenblatt
E, Casper R. Congenital malformations
among 911 newborns conceived after
infertility treatment with letrozole or
clomiphene citrate. Fertility and Sterility_
Vol. 85, No. 6, June 2006.
19. Forman R, Gill S, Moretti M, Tulandi T,
Koren G, Casper R. Fetal Safety of letrozole
and Clomiphene Citrate for Ovulation
Induction. J Obstet Gynaecol Can
2007;29(8):668-671.
20. Badawy A, Shokeir T, Allam AF, Abdelhady
H. Pregnancy outcome after ovulation
induction with aromatase inhibitors or
clomiphene citrate in unexplained infertility.
Acta Obstet Gynecol Scand.
2009;88(2):187-91.
21. Renseignements importants en matière
d’innocuité concernant la contre-indication
de Femara (létrozole) chez les femmes
préménopausées. Novembre 2005. www.
hc-sc.gc.ca/dhp-mps/medeff/advisories-
9. Min JK, Hughes E. Le transfert sélectif d’un
seul embryon à la suite de la fécondation in
vitro. JOGC 2010; 241: 478-94.
10. ASRM, Use of clomiphene citrate in women.
Fertil Steril, 2006. 86(5 Suppl 1): p. S187-93.
11. Rongières C, Moreau L, Lamarca E, Weber
P. Stimulation ovarienne, déclenchement
de l’ovulation et soutien de la phase lutéale.
In: Physiologie, pathologie et thérapie de la
reproduction chez l’humain. Spinger-
Verlag France, Paris, 2011. p. 403-21.
12. Silva Idos S, Wark PA, McCormack VA,
Mayer D, Overton C, Little V, Nieto J,
Hardiman P, Davies M, MacLean AB.
Ovulation-stimulation drugs and cancer
risks: a long-term follow-up of a British
cohort. Br J Cancer. 2009 Jun
2;100(11):1824-31. Epub 2009 May 12.
13. Jensen A, Sharif H, Kjaer SK. Use of fertility
drugs and risk of uterine cancer: results from
a large Danish population-based cohort
study. Am J Epidemiol. 2009 Dec
1;170(11):1408-14. Epub 2009 Nov 1.
14. Pritts, EA. Letrozole for ovulation
induction and controlled ovarian
hyperstimulation. Curr Opin Obstet
Gynecol. 22(4): p. 289-94.
15. Papanikolaou, EG et al. Aromatase
inhibitors in stimulated IVF cycles. Reprod
Biol Endocrinol. 9: p. 85.
16. Kamath, MS et George K. Letrozole or
MEDACTUEL DPC > MISE À JOUR SUR LES TRAITEMENTS DE L’INFERTILITÉ FÉMININE
puissants du CYP3A4, la dose quotidienne de VESICARE devrait
être maintenue ou ramenée à 5 mg par jour.
Dose recommandée et modifi cation posologique : La
dose recommandée de VESICARE est de 5 mg, une fois par jour.
Si la dose de 5 mg est bien tolérée, elle peut être augmentée
à 10 mg, une fois par jour. VESICARE doit être pris avec des
liquides et avalé entier. VESICARE peut être administré avec ou
sans aliments, sans égard aux repas. L'effet maximum peut
être déterminé après quatre semaines de traitement au plus tôt.
Dose oubliée : Si une dose est oubliée, le prochain comprimé
doit être pris comme prévu. Les doses ne doivent pas être
doublées pour compenser une dose oubliée.
1. Chapple CR, et al. Eur Urol 2005; 45: 464-470.
2. Chapple CR, et al. Eur Urol 2006; 49: 157-190.
RENSEIGNEMENTS SUPPLEMENTAIRES SUR LE
PRODUIT
MISES EN GARDE ET PRÉCAUTIONS
Fonction sexuelle/reproduction
Lors d'une étude de toxicité de 13 semaines chez des souris auxquelles on a administré
400 mg/kg/jour (15 fois l'exposition à la dose humaine maximum recommandée
[DHMR]) de succinate de solifénacine et lors d'une étude de toxicité de 26 semaines
chez des rats traités au moyen de 30 mg/kg/jour (< 1 fois l'exposition a la DHMR)
ou plus de succinate de solifénacine, une dégénérescence folliculaire/réduction du corps
jaune dans les ovaires et/ou une atrophie utérine ont été observées chez les animaux
de sexe féminin qui sont décédés ou qui ont été sacrifi és in extremis. Un poids utérin
faible et une immaturité utérine ont été observés chez des chiennes traitées au moyen de
3 mg/kg/jour (< 1 fois l'exposition à la DHMR) ou plus de succinate de solifénacine lors
d'une étude de toxicité de 13 semaines.
Le succinate de solifénacine n'a exercé aucun effet sur la fonction reproductive, sur la
fécondité ou le développement embryonnaire précoce du fœtus de souris mâles et femelles
traitées au moyen de 250 mg/kg/jour (13 fois l'exposition à la MRHD) de succinate de
solifénacine pendant 4 et 2 semaines, respectivement, chez des rats mâles traités au
moyen de 50 mg/kg/jour (< 1 fois l'exposition à la DHMR) pendant 4 semaines et
chez des rates traitées au moyen de 100 mg/kg/jour (1,7 fois l'exposition à la DHMR)
pendant 2 semaines.
Populations particulières
Femmes enceintes : Des études de reproduction ont été effectuées chez des souris, des
rats et des lapins. Après l'administration de succinate de solifénacine marqué au 14C à des
souris gravides, des éléments du médicament ont franchi la barrière placentaire. Aucune
embryotoxicité ni tératogénicité n'ont été observées chez les souris traitées au moyen de
30 mg/kg/jour (1,2 fois l'exposition à la dose humaine maximum recommandée
[DHMR]). L'administration de succinate de solifénacine à des souris gravides, à raison de
100 mg/kg/jour et plus (3,6 fois l'exposition à la DHMR), durant la période importante
de développement des organes a donné lieu à une diminution de la masse corporelle des
fœtus. L'administration de 250 mg/kg/jour (7,9 fois l'exposition à la DHMR) à des
souris gravides a donné lieu à une incidence accrue de fi ssures palatines. Les expositions
in utero et par l'allaitement à des doses maternelles de succinate de solifénacine de
100 mg/kg/jour et plus (3,6 fois l'exposition à la DHMR) a donné lieu à une survie
périnatale et post-natale réduite, à des réductions du gain pondéral et à un retard
du développement physique (ouverture des yeux et du vagin). Une augmentation
du pourcentage des rejetons de sexe masculin a aussi été observée dans les portées
provenant des rejetons exposés à des doses maternelles de 250 mg/kg/jour. Aucun
effet embryotoxique n'a été observé chez des rats jusqu'à 50 mg/kg/jour (< 1 fois
l'exposition à la DHMR) ou chez des lapins jusqu'à 50 mg/kg/jour (1,8 fois l'exposition
à la DHMR). On n'a noté aucun effet sur la mise bas naturelle chez la souris traitée
au moyen de 30 mg/kg/jour (1,2 fois l'exposition à la DHMR). L'administration de
succinate de solifénacine à raison de 100 mg/kg/jour (3,6 fois l'exposition à la DHMR)
ou plus a fait augmenter la mortalité périnatale des rejetons.
Femmes qui allaitent : Lors de l'administration orale de succinate de solifénacine
marqué au 14C à des souris allaitantes, la radioactivité a été décelée dans le lait maternel.
On n'a noté aucun effet indésirable chez les souris traitées au moyen de 30 mg/kg/
jour (1,2 fois l'exposition à la dose humaine maximum recommandée [DHMR]). Les
rejetons des souris femelles traitées au moyen de 100 mg/kg/jour (3,6 fois l'exposition
à la DHMR) ou plus ont présenté une réduction de leur masse corporelle, une mortalité
post-partum ou un retard des réfl exes et du développement physique durant la période
d'allaitement.
EFFETS INDÉSIRABLES
Effets indésirables du médicament lors des essais cliniques
VESICARE a été évalué sur le plan de l'innocuité chez 1 811 patients dans le cadre d'essais
randomisés et contrôlés par placebo. Lors des quatre essais cliniques à double insu d'une
durée de 12 semaines, on a noté trois réactions indésirables intestinales graves chez des
patients, tous traités au moyen de VESICARE à raison de 10 mg (fécalome, obstruction
du côlon et obstruction intestinale). Le taux global d'incidents indésirables graves lors des
essais à double insu a été de 2 %. Le tableau 1 dresse la liste des réactions indésirables,
peu importe leur lien de cause à effet, qui ont été signalés lors des essais randomisés
contrôlés par placebo, selon une incidence supérieure à celle du placebo et chez 1 % ou
plus des patients traités au moyen de VESICARE à raison de 5 ou 10 mg une fois par jour
pendant une période allant jusqu'à 12 semaines.
Tableau 1 : Pourcentage de patients présentant des réactions indésirables liées au
traitement, excédant le taux lié au placebo et signalées chez 1 % ou plus des sujets lors
d'essais déterminants combinés
Un jeune sujet de sexe masculin a présenté une augmentation réversible de ses taux
d'enzymes hépatiques après une seule dose de solifénacine lors d'une étude de phase I.
Bien que le lien de cause à effet n'ait pas été établi, il faut porter une attention spéciale
aux sujets qui développent des anomalies à leurs tests de fonction hépatique après avoir
débuté un traitement par solifénacine et faut envisager l'arrêt du traitement, selon le cas.
Effets indésirables signalés après la commercialisation : Outre les effets
indésirables observés lors des essais cliniques, les effets suivants ont été signalés en lien
avec l'utilisation de VESICARE depuis sa commercialisation à l'échelle mondiale, bien que
l'on n'ait pas toujours pu en confi rmer la fréquence ou le lien causal avec VESICARE.
Général : œdème périphérique
Cardiovasculaire : torsades de pointes
Troubles de l’oeil : glaucome
Gastrointestinal : refl ux gastro-oesophagien pathologique, iléus, vomissements
Hépatobiliaire : troubles hépatiques caractérisés principalement par des résultats
anormaux aux tests de la fonction hépatique : AST (aspartate aminotransférase), ALT
(alanine aminotransférase), GGT (gamma-glutamyl transférase)
Système immunitaire : réaction anaphylactique et réactions d’hypersensibilité
incluant éruptions cutanées, prurit et urticaire
Investigations : allongement de l’intervalle QT à l’électrocardiogramme
Métabolisme et nutrition : perte d’appétit et hyperkaliémie
Système nerveux : étourdissement, maux de tête et somnolence
Psychiatrique : état confusionnel, délire, désorientation et hallucination
Rénal et urinaire : insuffi sance rénale et rétention urinaire
Troubles respiratoires, thoraciques et médiastinaux : dysphonie
Peau et tissus sous-cutanés : angio-œdème avec obstruction des voies respiratoires,
dermatite exfoliative, érythème polymorphe
INTERACTIONS MÉDICAMENTEUSES
Interactions médicament-médicament : La solifénacine est métabolisée par
le CYP3A4. L'administration simultanée de kétoconazole (200 mg/jour), un puissant
inhibiteur du CYP3A4, a donné lieu à une augmentation du double de l'ASC de la
solifénacine, alors qu'une dose de 400 mg/jour de kétoconazole a donné lieu à une
augmentation du triple de l'ASC de la solifénacine. Par conséquent, la dose maximum de
VESICARE doit être limitée à 5 mg lorsqu'il est utilisé simultanément avec le kétoconazole
ou aux doses thérapeutiques d'autres puissants inhibiteurs du CYP3A4.
Tableau 2 : Interactions médicament-médicament potentielles étudiées
EC = Essai clinique
Interactions médicament-aliments : L'ingestion concomitante de jus de
pamplemousse et de VESICARE pourrait augmenter les taux sériques de solifénacine.
Interactions médicament-herbes médicinales : Les interactions avec les produits
dérivés de plantes médicinales n'ont pas été établies et la prudence s'impose si de tels
agents sont utilisés par les patients.
Interactions du médicament avec les essais de laboratoire : Les interactions
avec les essais de laboratoire n'ont pas fait l'objet de recherche.
SURDOSAGE
Aigu : Le surdosage par VESICARE peut éventuellement donner lieu à de sévères effets
anticholinergiques et doit être traité en conséquence. La dose de succinate de solifénacine
la plus élevée qui ait été administrée accidentellement à un seul patient a été de 280 mg
sur une période de 5 heures, dose qui a eu une incidence sur l’état mental. Le patient a
reçu un traitement au charbon et s’est rétabli sans séquelles.
Chronique : Des effets indésirables anticholinergiques intolérables (pupilles fi xes et
dilatées, vision trouble, échec du test talon-orteils, tremblements et sécheresse de la peau)
sont survenus au jour 3 chez des volontaires normaux qui prenaient 50 mg par jour (5 fois
la dose thérapeutique maximum recommandée) et sont rentrés dans l’ordre dans les sept
jours suivants l’arrêt du médicament.
Traitement du surdosage : Dans l’éventualité d’un cas de surdosage avec VESICARE,
il faut traiter par lavage gastrique et autres mesures de soutien des fonctions vitales. Une
surveillance ÉCG est également recommandée.
En cas de surdosage soupçonné, communiquez avec le centre antipoison
de votre region.
La monographie du produit est disponible sur demande.
Astellas Pharma Canada, Inc.
675 Cochrane Drive, bureau 500
Markham, ON
L3R 0B8
Nom du
médicament Réf. Effet Commentaires cliniques
Digoxine EC Aucun effet signifi catif sur
la pharmacocinétique de la
digoxine chez les sujets en
bonne santé
Kétoconazole EC solifénacine
La Cmax moyenne et l’ASC de
la solifénacine ont augmenté
selon un facteur de 1,5 et de
2,7, respectivement.
Il est recommandé de ne pas
excéder une dose quotidienne
de 5 mg de VESICARE lorsqu’il
est administré avec des doses
thérapeutiques de kétoconazole
ou d’autres puissants inhibiteurs
du CYP3A4.
Contraceptifs
oraux EC Aucun effet signifi catif sur la
concentration plasmatique
des contraceptifs oraux
combinés (éthinylestradiol/
lévonorgestrel).
Warfarine EC Aucun effet signifi catif sur
la pharmacocinétique de
la R-warfarine ou de la
S-warfarine.
SYSTÈME ORGANE CLASSE
Terme MedDRA préféré
Placebo
(%)
VESICARE
5 mg (%)
VESICARE
10 mg (%)
Nombre de patients 1 216 578 1 233
Nombre de patients ayant manifesté des
effets indésirables liés au traitement
634 265 773
Troubles oculaires
Vision trouble
Sécheresse oculaire NSA
1,8
0,6
3,8
0,3
4,8
1,6
Troubles digestifs
Sécheresse de la bouche
Constipation
Nausées
Dyspepsie
Douleurs abdominales hautes
Vomissements NSA
4,2
2,9
2,0
1,0
1,0
0,9
10,9
5,4
1,7
1,4
1,9
0,2
27,6
13,4
3,3
3,9
1,2
1,1
Malaises généraux et problèmes
au point d’administration
Fatigue
OEdème aux membres inférieurs
1,1
0,7
1,0
0,3
2,1
1,1
Infections et infestations
Infection urinaire NSA
Infl uenza
Pharyngite NSA
2,8
1,3
1,0
2,8
2,2
0,3
4,8
0,9
1,1
Troubles du système nerveux
Étourdissements 1,8 1,9 1,8
Troubles psychiatriques
Dépression NSA 0,8 1,2 0,8
Troubles rénaux et urinaires
Rétention urinaire 0,6 0 1,4
Troubles respiratoires,
thoraciques et médiastinaux
Toux 0,2 0,2 1,1
Troubles vasculaires
Hypertension NSA 0,6 1,4 0,5
Références des études
38204 VE-2015-FP-PI-1F_F4.indd 2 12-03-19 9:41 PM
1
/
5
100%