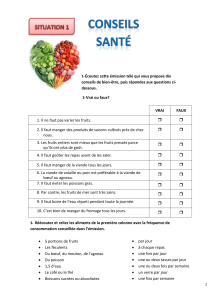
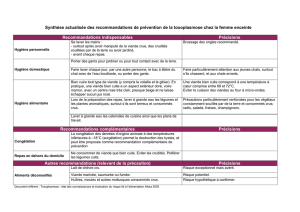
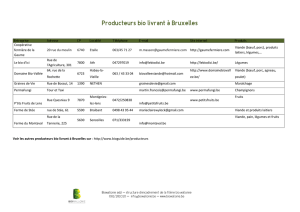
L : Cuisson et cancer ?

504 | La Lettre du Cancérologue • Vol. XXI - n° 10 - décembre 2012
MISE AU POINT
Cuisson et cancer :
pourquoi pas ?1
Cooking and cancer: why not?
J.M. Lecerf*
1 © Correspondances en Métabolis-
mes Hormones Diabètes et Nutri-
tion 2012;XVI (5-6):155-60.
* Service de nutrition, institut Pas-
teur, Lille.
Le rôle de certaines habitudes alimentaires dans
la survenue des cancers est évoqué depuis les
travaux de D. Burkitt et ceux de H. Trowell, et
cette notion a été soutenue par une étude de R. Doll
et R. Peto (1), célèbres épidémiologistes britanniques.
En 1997, puis en 2007, le rapport du World Cancer
Research Fund (WCRF) a rendu des avis graduels sur
le risque de cancer lié à l’alimentation. Alors qu’il
n’est pas convenu de parler d’aliment anticancer, des
études ont conduit à évoquer un risque attaché à un
aliment précis, la viande. Ainsi, le WCRF concluait en
2007 que ce risque était convaincant pour la viande,
avec un risque relatif de cancer colorectal de 1,29
(IC95 : 1,04-1,60) par 100 g consommés par jour. Si
les méta-analyses permettent de fournir ces chiffres,
les données ne sont homogènes ni selon les études, ni
selon les populations. En effet, la viande ne peut pas
être considérée, d’un point de vue alimentaire, indé-
pendamment de l’alimentation globale dans laquelle
elle s’inscrit, et des procédés de transformation qu’elle
subit. C’est le cas de la cuisson. Celle-ci peut générer
l’apparition de substances – les amines hétérocycliques
(AH) – dont on sait qu’elles s’avèrent mutagènes sur
les tests de Ames/Salmonella, et sont cancérogènes
chez l’animal. La présence des AH ne pourrait-elle pas
rendre compte en partie des différences en termes de
risque de cancer selon les études et de la relation entre
la consommation de viande et la survenue, outre les
cancers colorectaux, d’autres cancers ?
Données expérimentales
Les dérivés des AH produits par le métabolisme
humain provoquent des mutations dans différents
types de cellules. Ils se lient à l’ADN au niveau de sites
riches en base GC (guanine et cytosine) en formant
des adduits (2). Chez les rongeurs, leur administra-
tion par voie orale entraîne la formation de tumeurs
dans de nombreux organes cibles : foie, poumon,
côlon, intestin, peau, glandes mammaires (3). Chez
les singes, le composé IQ induit des tumeurs hépa-
tiques dans 65 % des cas après 7 ans d’exposition
à des doses de 10 à 20 mg/kg 5 jours sur 7 (4). Le
PhIP provoque plutôt des lymphomes, ainsi que des
cancers du côlon et des glandes mammaires chez
le rat (5). Les nouveau-nés de souris sont encore
plus sensibles ; or, le PhIP peut passer de la mère
au fœtus à travers le placenta durant les derniers
jours de la gestation, et le lait maternel constitue
une autre voie d’exposition aux AH (6).
La nourriture représente chez l’homme la principale
source d’AH : on en retrouve ainsi dans les urines
de volontaires humains ayant une alimentation
normale, mais pas dans celles d’individus nourris
par voie parentérale (7). Cependant, les doses testées
en toxicologie sont beaucoup plus élevées que celles
auxquelles les sujets sont soumis dans le cadre d’une
alimentation courante.
Les AH sont retrouvés en quantité faible, mais signifi-
cative, lors de la cuisson des viandes et des poissons,
d’autant plus que la température de la poêle s’élève
(pour une même température de 70 °C au cœur de la
viande) et ce pour des cuissons brèves (30 minutes),
et en quantité même très élevée dans les sauces, les
extraits de viande, les arômes de viande, les résidus
de poêles, etc. Seules les études épidémiologiques
peuvent apporter des éléments plus formels.
Nous n’aborderons que très peu la problématique
différente et bien établie du caractère cancérogène
des hydrocarbures aromatiques polycycliques (HAP)
issus de la cuisson au feu de bois, au charbon, au
contact des flammes, de la fumée (type barbecue).
Nous aborderons également brièvement la ques-
tion de l’acrylamide, composé de Maillard, et de
son éventuel rôle cancérogène.

La Lettre du Cancérologue • Vol. XXI - n° 10 - décembre 2012 | 505
Points forts
»
Lorsque de la viande est cuite à température élevée et/ou grillée, des amines hétérocycliques se forment
(viande bien cuite).
»Ces molécules sont expérimentalement cancérogènes.
»
Les études épidémiologiques montrent nettement leur rôle dans l’apparition du cancer colorectal, mais
aussi du cancer du sein, de la prostate, du poumon, de la vessie et du pancréas. Cela pourrait en partie
rendre compte du lien entre une consommation élevée de viande et la survenue d’un cancer.
»Des facteurs génétiques modulent les effets de leur consom-mation.
»Leur apparition dépend de nombreux facteurs culinaires et peut être limitée par certains usages.
»
Des recommandations diététiques et culinaires pratiques doivent être élaborées pour la prévention
des cancers.
Mots-clés
Cancer
Amines
hétérocycliques
Viande
Cuisson
Cancer colorectal
Highlights
»
On high-heated or grilled
meat cooking, heterocyclic
amines occurr (well-done
meat).
»
These molecules have a
cancerogenic effect.
»
Epidemiological studies have
shown that they have a role in
the colorectal, breast, prostate,
lung, bladder, and pancreatic
cancer risk.
»
This could partially explain
the relationship between high
meat consumption and cancer.
»
Genetic factors may modu-
late the effect of heterocyclic
amines on that risk.
»
Their occurrence in foods
depends from many cooking
factors and may be decreased
with some uses.
»
Practical dietary and culi-
nary recommendations must
be made for cancer prevention.
Keywords
Cancer
Heterocyclic amines
Meat
Cooking
Colorectal cancer
Les composés néoformés
lors de la cuisson
Les composés néoformés lors de la cuisson sont
de 4 types : les composés de Maillard, les amines
hétérocycliques, les produits d’oxydation et les
hydrocarbures aromatiques polycycliques.
Les produits de la réaction de Maillard
Les produits de la réaction de Maillard résultent de
l’interaction entre des sucres réducteurs (hexoses)
et des acides aminés, suivie d’un ensemble complexe
d’étapes donnant naissance à des composés variés,
dont les principaux sont les composés carbonylés :
N carboxyméthyllysine (CML), hydroxyméthylfur-
fural (HMF) et acrylamide.
La principale source d’acrylamide est représentée
par les produits tels que les frites, les chips, le pain,
les céréales transformées. On en retrouve peu dans
la viande. L’acrylamide présente dans les tissus bio-
logiques provient aussi du tabagisme.
Les produits d’oxydation
Les produits d’oxydation sont des molécules issues
des réactions de thermo-oxydation des corps gras,
notamment insaturés. Ils ne sont pas spécifiques de
la viande. Ils sont surtout liés au chauffage excessif
des graisses de cuisson, notamment des lipides riches
en acides gras insaturés.
Les hydrocarbures aromatiques
polycycliques
Les HAP sont issus de la combustion incomplète
de sub-stances organiques à partir des radicaux
libres générés au cours des réactions de pyrolyse
et de pyrosynthèse (8). La température très élevée,
la cuisson au feu de bois, au charbon, au contact
de la flamme ou de la fumée entraînent l’appari-
tion de substances telles que le benzo(a)pyrène, le
dibenzo(a)pyrène, le dibenzo(a)anthracène et plus
de 100 autres composés. Ces molécules hautement
cancérogènes sont essentiellement produites lors
de la cuisson sévère des aliments gras au contact
du bois et des hydrocarbures fossiles et confèrent
à l’aliment carbonisé une croûte noire qui y adhère.
Les sources directes principales de ces HAP sont le
tabagisme, la pollution et l’exposition profession-
nelle, tous susceptibles d’agresser directement la
peau et la muqueuse respiratoire.
Les amines hétérocycliques
Plus de 25 AH ont été isolés et identifiés comme
potentiellement mutagènes. Tous contiennent de
2 à 5 cycles aromatiques, avec 1 atome d’azote (N)
ou plus dans ce noyau, et habituellement un grou-
pement aminé non cyclique (8-10).
Les AH sont constitués lors de la cuisson. Leur
formation dépend de la température, qui détermine
2 familles d’AH : ceux formés à une température
comprise entre 100 et 300 °C et appelés AH ther-
miques, du type IQ (indoles quinolines ou indoles
quinoxalines), qui sont des amino-imidazo-aza-
arènes et des composés polaires ; et ceux formés à
de plus hautes températures (supérieures à 300 °C),
appelés AH pyrolytiques, de type non IQ, qui sont
des amino-carbolines et des composés non polaires.
Les premiers sont générés à partir de la réaction
entre des acides aminés libres (la créatine et la créa-
tinine) et des hexoses, et donc à partir des composés
de Maillard, conduisant à des pyridines et pyrazines
hétérocycliques, puis aux IQ.
Les seconds apparaissent au-delà de 250 à 300 °C
à partir de la dégradation des premiers à travers la
réaction de pyrolyse entre les acides aminés et les
protéines.
Les principaux amino-imidazo-aza-arènes sont DMIP,
PhIP, iso IQ, IQ, MeIQ, IQx, MeIQx, Di MeIQx, etc.
Les principaux amino-carbolines sont α, β, γ et δ
carbolines, Phe-P-1, Orn-P-1 Cre-P-1, Lys-P-1, etc.
Les niveaux d’AH formés lors de la cuisson des
viandes varient entre 0,2 et 650 μg/g selon le mode
de cuisson utilisé ; PhIP représente dans tous les cas
l’AH majoritaire (11). La formation des AH, surtout
lors de la cuisson des viandes et des poissons, a été
décrite pour la première fois en 1964 (12), et leur
caractère cancérogène chez l’animal a été établi

506 | La Lettre du Cancérologue • Vol. XXI - n° 10 - décembre 2012
Cuisson et cancer : pourquoi pas ?
MISE AU POINT
en 1987 (13). En 2009, une importante revue de la
littérature se prononçait nettement en faveur de
l’augmentation du risque de cancer lié à la consom-
mation de viande “bien cuite” (well-done) [14].
Cancer et adénome colorectal
Une coloscopie réalisée chez 807 femmes asympto-
matiques a mis en évidence 158 adénomes colorec-
taux (15). Le risque d’adénome colorectal était de
1,72 (IC
95
: 0,96-3,07) pour la consommation de
viande cuite à la poêle (p = 0,01) et de 1,90 pour les
apports estimés en amines hétérocycliques (MeIQx).
Dans l’étude prospective EPIC-Heidelberg sur
25 540 sujets, 516 adénomes colorectaux ont
été dénombrés (16). Le risque relatif d’adénome
colorectal était de 1,47 (IC
95
: 1,13-1,93) pour les
apports de PhIP, avec une forte significativité
(p = 0,002) pour les petits adénomes et adénomes
distaux ; il s’élevait à 1,27 pour les apports de MeIQx,
à 1,18 pour les apports de Di MeIQx, et à 1,36 (IC
95
:
1,05-1,76 ; p = 0,04) pour la consommation de viande
“bien cuite”.
Deux études cas-témoins ont montré une corréla-
tion entre la préférence pour les parties fortement
grillées (surface brune) des viandes et le risque de
cancer du côlon (17, 18).
En 2005, une revue de la littérature ayant analysé
15 études épidémiologiques a montré un risque
de cancer colorectal accru (de 1,3 à 8,8 fois plus
important) dans 12 études où l’information était
présente pour la consommation de viande “bien
cuite” (9).
Cependant, dans l’étude cas-témoins de
K. Augustsson et al., aucun lien n’a été fait entre
les apports en AH et le risque de cancer (19). De
même, une autre étude cas-témoins n’a pas mis en
évidence de lien entre la consommation de viande
“bien cuite” et le risque de cancer colorectal (20).
Cette étude cas-témoin australienne a observé une
relation inverse (OR = 0,73 ; IC95 : 0,55-1,01) entre
la fréquence de consommation de viande rouge
cuite et le risque de cancer colorectal (21) ; toute-
fois, en tenant compte de la taille des portions, puis
du caractère bien cuit de la viande, cette associa-
tion inverse persiste mais n’est plus significative.
Les auteurs considèrent que, dans la plupart des
études, la mesure de l’exposition à la consommation
de viande n’est pas assez précise quand il s’agit de
prendre en considération le mode de cuisson. Il faut
en effet noter que, dans la plupart des études, les
apports en AH sont estimés sur la base des apports
en viande et des teneurs en AH dans les tables de
composition selon le degré et le mode de cuisson,
et ne sont pas mesurés.
Autres cancers
Cancer du sein
L’étude de Shangai chez 3 015 femmes âgées de 25 à
64 ans a montré une association positive (OR = 1,92)
entre la consommation de viande rouge et le cancer
du sein, dans le cas d’une viande “bien cuite” ou
cuite en friture (22).
Dans un échantillon de 35 644 sujets âgés de 35 à
75 ans de l’étude EPIC, le mode de cuisson à haute
température semble expliquer l’hétérogénéité des
résultats entre les pays (23) : il concerne 15 % des
sujets en Italie du Nord et 49 % aux Pays-Bas ; la
cuisson par friture, grill et barbecue représente 12 g
de viande par jour dans le sud de l’Espagne et 91 dans
le nord. Dans la population féminine de cette étude
(319 826 femmes âgées de 20 à 70 ans), répartie
entre 10 pays et 23 centres européens, la relation
entre cancer du sein et consommation de viande
rouge (pour 150 g/j) est élevée (HR = 1,16 ; IC95 :
1,03-1,32) dans les pays où la proportion de viande
cuite à haute température est forte, alors qu’elle
n’existe pas (HR = 0,82 ; IC95 : 0,63-1,07) dans les
pays où cette proportion est faible. On observe par
ailleurs une interaction significative entre la viande
rouge cuite à haute température et le cancer du sein
(p = 0,017) [24].
Une étude cas-témoins aux États-Unis n’a pas
montré de relation entre le risque de cancer du
sein, les apports en AH et l’estimation de l’activité
mutagène de la viande (25).
Dans une étude prospective américaine auprès de
52 158 femmes âgées de 55 à 74 ans, le risque de
cancer du sein invasif est accru en cas de consom-
mation plus élevée de MeIQx (HR = 1,26 ; IC
95
: 1,03-
1,55), mais pas de Di MeIQx (26).
Dans l’étude de la Swedish Mammography Cohort
auprès de 61 433 Suédoises suivies pendant 17,4 ans,
il existe une interaction avec des facteurs hormo-
naux, puisque le risque de cancer invasif est accru
pour la consommation de viande grillée ou poêlée
chez les patients ayant des récepteurs aux estrogènes
ER+ et des récepteurs à la progestérone PR− (27).
Dans une revue de la littérature analysant 7 études
prospectives, on constate, lorsque les données sont
disponibles (6 études sur 7), que le risque relatif de

La Lettre du Cancérologue • Vol. XXI - n° 10 - décembre 2012 | 507
MISE AU POINT
cancer du sein est accru en cas de consommation de
viande grillée ou “bien cuite” : il passe de 1,92 à 4,6
(9). Cela a été observé dans l’étude Iowa Women’s
Health Study auprès de 41 836 femmes âgées de 55
à 69 ans, chez qui une relation de type dose-réponse
entre la consommation de viande “bien cuite” et le
risque de cancer du sein a été mise en évidence (28).
En ce qui concerne l’acrylamide, issu principalement
des céréales, du pain et des pommes de terre, les
premières études ont été menées sur la base d’une
estimation des apports. Deux études cas-témoins et
une étude prospective (29-31) n’ont pas montré de
corrélation entre l’apport en acrylamide et le risque
de cancer du sein, mais une étude fondée sur le taux
d’acrylamide et de son métabolite, la glycinamide, et
les adduits sur l’hémoglobine N terminale a montré,
après ajustement sur le tabac, une relation entre ce
paramètre biologique et le risque de cancer du sein
récepteur aux estrogènes récepteur + (32).
Cancer de la prostate
Dans l’étude américaine NIH-AARP Diet and Health
Study auprès de 175 343 hommes âgés de 50 à 71 ans
et suivis pendant 9 ans, le risque de cancer de la
prostate est modérément élevé en cas de consom-
mation de viande grillée/barbecue (HR = 1,11 ; IC95 :
1,03-1,19) ou d’apports élevés en benzo(a)pyrène
(HAP) [HR = 1,09 ; IC95 : 1,00-1,18], mais le risque
de cancer avancé est beaucoup plus élevé (respec-
tivement HR = 1,36 et 1,28) [33].
Chez 1 294 hommes ayant eu un cancer de la pros-
tate et suivis pendant 2 ans en moyenne, la progres-
sion (décès, métastases ou augmentation du PSA)
n’est observée que pour une consommation élevée
de poulet avec (et non pas sans) la peau (HR = 2,26 ;
IC
95
: 1,36-3,76 ; p = 0,003) [34]. Or, la viande de
poulet “bien cuite”, grillée, est plus riche en HA que
les autres viandes, et le poulet avec la peau est beau-
coup plus souvent cuit grillé.
Cancer du poumon
Une étude cas-témoin italienne rapporte une corré-
lation entre les apports en AH et en benzo(a)pyrène
et le risque de cancer du poumon (35).
L’étude de la cohorte NIH-AARP Diet and Health
Study auprès de 278 380 hommes suivis pendant
8 ans a également montré une corrélation entre la
consommation de viande rouge “bien cuite” ou “très
bien cuite” (HR = 1,20 ; IC
95
: 1,04-1,38 ; p = 0,04) et
le risque de cancer du poumon ; une relation iden-
tique a été observée avec les apports en MeIQx
(HR = 1,25 ; IC95 : 1,07-1,45 ; p = 0,02) [36].
Cancer du pancréas
J. Zhu et al. ont montré que la teneur en adduits
ADN/PhIP était associée à une augmentation du
risque de cancer du pancréas et à la préférence pour
la viande “bien cuite” (37).
Une étude cas-témoin a montré une corrélation
entre les apports en amines hétérocycliques et le
risque de cancer du pancréas pour PhIP (OR = 1,8 ;
IC
95
: 1,0-3,1), Di MeIQx (OR = 2,0 ; IC
95
: 1,2-3,5) et
MeIQx (OR = 1,5 ; IC95 : 0,9-2,7) et pour le benzo(a)
pyrène (OR = 2,2 ; IC95 : 1,2-4,0) [38].
Cancer de la vessie
Au cours de l’étude prospective NIH-AARP Diet
and Health Study, 854 cas de cancer de la vessie
ont été identifiés lors du suivi pendant 7 ans de
300 933 hommes et femmes. Le risque relatif de
cancer de la vessie était de 1,19 (IC
95
: 0,95-1,48 ;
p = 0,06) pour les apports estimés en PhIP (39).
Dans une récente étude cas-témoins, le risque de
cancer de la vessie était très augmenté pour les
deuxième, troisième et quatrième quartiles d’apports
en AH, avec un OR respectif de 1,47, de 2,58 et de
3,32 (p < 0,001) [40].
Facteurs déterminant la teneur
en AH
➤
La température, la durée et la méthode de
cuisson affectent la teneur en AH ; il existe une rela-
tion avec le degré de température, mais elle n’est
pas linéaire pour tous les AH. Au-delà de 200 °C,
la quantité d’AH augmente dramatiquement, alors
qu’en dessous de 150 °C, elle n’est pas détectable.
➤
Le type de viande intervient également. La peau
(de poulet) est un facteur mécanique protecteur
pour la viande ; certains AH (PhIP) sont plus faci-
lement formés dans la viande de poulet, tandis
que d’autres (8-MeIQx) le sont moins que dans le
viande de bœuf et de porc. La teneur en créatine
et celle en glycogène peuvent être déterminantes.
Cette dernière dépend de facteurs génétiques
propres à l’animal : l’allèle RN– confère à la viande
une teneur plus forte en glycogène, une couleur

508 | La Lettre du Cancérologue • Vol. XXI - n° 10 - décembre 2012
Cuisson et cancer : pourquoi pas ?
MISE AU POINT
plus foncée et une moindre formation de certains
AH malgré une couleur brune en surface. Tout cela
peut expliquer certaines discordances épidémio-
logiques.
➤
La durée de cuisson joue un rôle : en deçà de
5 minutes, certains AH n’apparaissent pas ; au bout
d’un certain temps, un plateau apparaît, car des AH
peuvent être détruits.
Selon la teneur en graisse de la viande, la durée
nécessaire pour atteindre la température souhaitée
peut être raccourcie : en effet, le gras permet un bon
transfert de la chaleur, ce qui permet de générer
moins d’AH. La formation de certains AH peut aussi
venir de la pyrolyse de gouttelettes de jus de viande
qui tombent sur les flammes, sont transportées
avec la fumée et se déposent sur la viande.
➤
Le mode de cuisson intervient : la cuisson au
micro-ondes peut entraîner l’apparition d’AH du
type carbolines, la friture celle d’IQ et de carbo-
lines. La cuisson bouillie, rôtie ou en bain de friture
induit une température plus basse et donc moins
d’AH. La cuisson en friture plate (contact avec une
poêle), au grill ou au barbecue génère le plus d’AH
en raison du niveau de température et de la perte
en eau.
➤
L’ajout de sucre en excès retarde la formation
d’AH du fait d’une interaction avec la réaction de
Maillard : dans ce cas en effet, les produits de Mail-
lard sont plus rapidement formés ; ils interagissent
avec la créatine ou la créatinine, ce qui conduit à
réduire la teneur en glucose. En présence d’un excès
de sucre, les acides aminés ne participent pas à la
réaction non enzymatique de brunissement (réac-
tion de Maillard), ce qui les rend moins disponibles
pour la formation d’AH. De plus, les produits de
Maillard peuvent réagir avec les molécules muta-
gènes, ce qui réduit encore la teneur en AH.
➤
Le fait de faire mariner la viande pendant 6 à
24 heures dans du vin ou de la bière diminue la
formation d’AH. L’utilisation d’épices réduit égale-
ment l’apparition d’AH, sans doute en raison des
antioxydants qu’elles contiennent, ce qui inactive
les radicaux libres générés comme intermédiaires
dans la réaction de Maillard. C’est le cas aussi des
marinades contenant des épices riches en antioxy-
dants polyphénoliques. Les composés phénoliques
qui inhibent le plus la formation d’AH semblent
être le thé et l’huile d’olive (vierge), ainsi que la
naringénine des agrumes. Les composés soufrés
de l’ail exercent également un effet favorable, de
même que les caroténoïdes de la tomate ! L’ajout
d’huile de maïs augmente la formation d’AH du
fait des lipoperoxydations induites ; la cuisson à
l’huile de coprah, avec du lard ou de l’huile de soja
induit aussi cette formation. Mais c’est surtout dans
les fonds de poêle que l’on retrouve le plus d’AH
après l’usage de matières grasses, de façon moindre
cependant en cas d’utilisation d’une margarine
contenant un peu de lait.
Facteurs de variation des AH
ou de leurs effets in vivo
Des apports élevés en légumes crucifères (tel
le chou) pendant 12 jours réduisent l’excrétion
urinaire de 8-MeIQx et de PhIP (41). Cela est vrai-
semblablement dû à l’augmentation du méta-
bolisme des AH et à l’activation de systèmes de
détoxication via les cytochromes par les crucifères.
On sait par ailleurs qu’il existe des phénotypes
variables d’acétyleurs des AH pouvant expliquer des
différences selon les individus et les populations.
Un risque accru de cancer du côlon a été observé
chez les acétyleurs rapides NAT2 (42). Le double
phénotype rapide pour CYP1A2 et NAT2 augmente
ainsi considérablement le risque de cancer du
côlon en cas de consommation de viande cuite
(OR = 6,45) [43]. Une autre étude montre que
le phénotype CYP1A2 affecte le risque de cancer
colorectal lié au tabagisme, mais pas celui engendré
par la consommation de viande rouge, quel que
soit le mode de cuisson (44). Le rôle du double
polymorphisme génétique rapide NAT2 et CYP1A2
prédisposant à une plus grande sensibilité aux carci-
nogènes délivrés par une cuisson à haute tempé-
rature a été suggéré dans les études comparant
des Japonais vivant à Hawaï et des Hawaïens de
naissance (45), et confirmé dans une étude améri-
caine montrant que le risque de cancer colorectal
associé à la consommation de viande rouge “bien
cuite” était plus élevé avec les 2 variantes CYP1B1
et SULTA1 (46). Une étude n’a pas montré de varia-
tion du risque de cancer du sein selon le génotype
NAT2 et les apports en AH (24).
L’impact d’autres facteurs nutritionnels a été analysé
de la façon suivante dans l’étude EPIC-Heidelberg :
si l’apport en flavonols (polyphénols) est inférieur
aux apports médians, l’effet de PhIP sur le risque
d’adénome colorectal est plus élevé, puisque le RR
passe de 1,47 à 1,76 (IC
95
: 1,17-2,65) [16]. On sait que
les produits laitiers réduisent le risque de cancer du
côlon ; le rôle des ferments lactiques pourrait inter-
venir : chez le rat, Lactobacillus diminue l’excrétion
urinaire des AH, ce qui pourrait signifier qu’ils sont
moins absorbés (47).
 6
6
 7
7
1
/
7
100%