Application des systèmes immunitaires artificiels aux images medicales - application/pdf

République Algérienne Démocratique et Populaire
Ministère de l’Enseignement Supérieur et de la Recherche Scientifique
Université des Sciences et de la Technologie -Mohamed Boudiaf- d’Oran
Faculté des Sciences
Département d’Informatique
Mémoire pour l’obtention du diplôme de Magister en Informatique
Option : Modélisation & Simulation
Présenté par :
Mr Nadjib GUETTARI
Devant le jury :
Mr Abdelkader BENYETTOU Professeur USTO-MB Président
Mr Mohamed BENYETTOU Professeur USTO-MB Rapporteur
Mr Khaled BELKADI Maître de conférence USTO-MB Examinateur
Mme Hadria FIZAZI IZABATENE Maître de conférence USTO-MB Examinatrice
Laboratoire de Modélisation et d’Optimisation des Systèmes Industriels
Année universitaire 2009/2010
Application des Systèmes
Immunitaires Artificiels aux
Images Médicales

T ÅÉÇ àÜ¢á v{xÜ Ñ¢Üx
T ÅÉÇ àÜ¢á v{xÜ Ñ¢ÜxT ÅÉÇ àÜ¢á v{xÜ Ñ¢Üx
T ÅÉÇ àÜ¢á v{xÜ Ñ¢Üx
T ÅÉÇ twÉÜtuÄx àÜ¢á v{¢Üx Å¢Üx
T ÅÉÇ twÉÜtuÄx àÜ¢á v{¢Üx Å¢Üx T ÅÉÇ twÉÜtuÄx àÜ¢á v{¢Üx Å¢Üx
T ÅÉÇ twÉÜtuÄx àÜ¢á v{¢Üx Å¢Üx
T ÅÉÇ yâàâÜ xÇytÇà
T ÅÉÇ yâàâÜ xÇytÇàT ÅÉÇ yâàâÜ xÇytÇà
T ÅÉÇ yâàâÜ xÇytÇà

Remerciements
Tout d’abord, je remercie le bon dieu, tout puissant de m’avoir donné la volonté et le
courage de mener à bien ce travail.
Je tiens particulièrement à exprimer mes profonds remerciements à mon encadreur Mr le
professeur BENYETTOU Mohamed, directeur du laboratoire de recherche Modélisation et
Simulation, LAMOSI à l’Université des Sciences et de la Technologie d’Oran, pour sa
disponibilité malgré ses occupations, son écoute, ses conseils et sa confiance m’ont été toujours
précieux, pour tous les encouragements et les aides qu’il n’a cessé de me donner, encore une fois
merci Monsieur.
Mes plus sincères remerciements vont également à Mr BENYETTOU Abdelkader,
Professeur et vice recteur de la post-graduation à l’Université des Sciences et de la Technologie
d’Oran, de m’avoir toujours honorer de présider mon jury. Et je tien également a remercier le
docteur FIZAZI IZABATEN Hadria et le docteur BELKADI Khaled en leur qualité
d’examinateurs, qui m’ont fais l’honneur d’avoir accepté de juger mon travail.
Un merci tout spécial à toutes les personnes qui m’ont aidé pendant cette période au sein
de mon laboratoire LAMOSI : à Melle SERRAT Amel, Melle BENTAOUZA Chahinez et Melle
BERRICHI Fatima.
Mes plus chaleureux remerciements s’adressent à mes très chers parents qui n’ont jamais
cessé de me soutenir et m’encourager durant toute cette longue période. Aucun mot n’est assez
fort pour leur exprimer la reconnaissance sincère que je leur porte pour la richesse de leur
enseignement. Du fond du cœur Merci.
J’adresse mes remerciements tout particulièrement à toute ma famille GUETTARI,
BOUDRAA et OUASTI.
A mes fidèles amis de toujours : MUSTAPHA, MEHDI, IBRAHIM.
Je tiens à remercier Le Directeur Générale de la SARL « Planète Auto », ainsi qu’à tous
mes collèges, que je prends le temps de les remercier tous et toutes individuellement.
Enfin mes remerciements, je les adresse à une personne très chère à moi, qui a eu la
lourde tâche durant cette période, de m’avoir aider, écouter et surtout supporter, je la remercie
pour sa présence permanente, elle n’a jamais cessé de m’encourager et de me pousser, sans elle
cette thèse n’aura jamais vu le jour. Ma très chère femme NASSIMA.
A tous ceux qui m’aiment et m’estiment …
Encore à tous un grand merci.

Résumé
e nos jours les algorithmes et les applications ont su développer et
révolutionner l’imagerie médicale et le diagnostic de celle-ci.
Dans notre travail nous avons utilisé une des techniques ,les plus
récentes, du traitement automatique et de la reconnaissance des formes, cette
méthode s’appelle les SIA (systèmes Immunitaires Artificiels).Ces algorithmes
exploitent typiquement les caractéristiques des systèmes immunitaires
biologiques, pour ce qui est de l’apprentissage et de la mémorisation comme
moyens de résolution des problèmes de classification , nous les avons utilisé pour
la classification des tumeur cérébrale d’ images IRM. Nous avons pus avoir neuf
classes des tumeurs de quatre grades différents, et des résultats satisfaisants.
Pour ne pas manipuler plusieurs paramètres et perdre beaucoup de temps dans
l’apprentissage et dans le but d’améliorer les SIA, nous avons utilisé une
méthode d’optimisation: les algorithmes génétiques, avec deux méthodes
différentes. En comparant notre travail avec un classificateurs comme les SVMs
(supports vecteurs machines), les SIA ont montré une meilleur performance.
Mot clés : Le système immunitaire artificiel, sélection clonale, traitement d’image
médicale, tumeur cérébrale, l’algorithme génétique.
Abstract
owadays, algorithms and applications have developed and
revolutionizing medical imaging and their diagnosis.
In our work we used one of the most recent techniques in automatic
processing and pattern recognition, this method is called AIS (Artificial Immune
Systems). These algorithms typically exploit the features of biological immune
systems, for who is learning and memorization as a means of solving problems
of classification, we have used for classification of brain tumors of MRI images.
We could have nine classes of tumors of four different grades, and satisfactory
results. To not manipulate several parameters and lose much time in learning and
to improve the AIS, we used a method of optimization: genetic algorithms with
two different methods. In comparing our work with classifiers such as SVMs
(Support Vector Machine) AIS were up a better performance.
Key word: The artificial immune system, clonal selection, medical image
processing, cerebral tumour, genetic algorithm.
D
N

Sommaire
Introduction générale
…………………………………………………………………..........1
Chapitre 1 : Imagerie Médicale
………………………………………..………………...3
1. Introduction .............................................................................................................................................. 4
2. Modalités d’acquisition d’images médicales ......................................................................................... 5
2.1. Radiographie Conventionnelle Ou Standard............................................................................... 5
2.2. Tomodensitométrie ou Scanner X: Scanographie ....................................................................... 5
2.3. Scintigraphie Et Gammagraphie .................................................................................................... 7
2.4. Echographie ...................................................................................................................................... 8
2.5. IRM (Imagerie par Résonance Magnétique) ............................................................................... 10
3. Systèmes d'aide a l'interprétation des images médicales ................................................................... 12
4. Cadre général de l'interprétation d'images médicales ........................................................................ 13
4.1. L’acquisition .................................................................................................................................... 14
4.2. Numérisation ................................................................................................................................... 14
4.3 Prétraitement .................................................................................................................................... 15
4.4 Segmentation .................................................................................................................................... 16
4.5 Reconstruction 3D .......................................................................................................................... 17
4.6 Reconnaissance et Classification ................................................................................................... 18
5. De nouveaux outils pour le diagnostic ................................................................................................ 19
6. La maladie du cancer ............................................................................................................................. 19
6.1. Qu'est-Ce Que Le Cancer ? .......................................................................................................... 19
6.1.1. Division Cellulaire Normale .................................................................................................. 20
6.1.2. Division Cellulaire Anarchique ............................................................................................. 21
6.2. Les Tumeurs Du Cerveau ............................................................................................................. 21
6.2.1. Tumeur cérébrale primaire et tumeur cérébrale métastatique ou secondaire, la
différence ? ......................................................................................................................................... 22
6.2.2. Tumeurs Cérébrales Bénignes Et Tumeurs Cérébrales Malignes .................................... 22
7. Conclusion .............................................................................................................................................. 26
Chapitre 2 : Les systèmes immunitaires Naturels
……......…......…......…................27
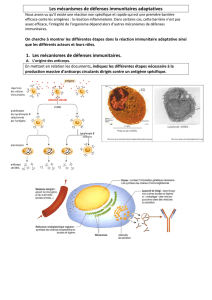
1. Introduction ............................................................................................................................................ 28
2. Structure et fonctionnement ............................................................................................................... 29
2.1. Cellules ............................................................................................................................................. 29
2.1.1. Les granulocytes ...................................................................................................................... 29
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
1
/
129
100%