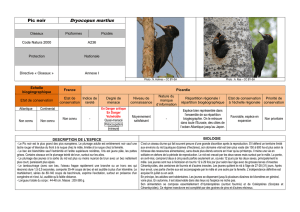
Huit espèces d`insectes associées aux forêts matures et anciennes

115
LE NATURALISTE CANADIEN, VOL. 125 No 3 AUTOMNE 2001
LES INSECTES
OrdreEspèce
Microhabitats
Arbres morts :
source de nourriture Picea mariana Mill. BSP
Coleoptera
Melanophila abies Champlain & Knull
Thuya occidentalis Linné
Coleoptera
Callidium violaceum Linné
Arbres morts :
substrat recherché
Organismes à
propagation lente
Reproduction hivernale,
déplacements limités (?)
DipteraChionea valga Harris
Polypore : Fomitopsis pinicola
(Schwarts: Fr.) Karst
ColeopteraCylindroselloides dybasi Hall
Polypore : Fomitopsis pinicola
(Schwarts: Fr.) Karst (?)
Coleoptera
Thrimolus minutus Casey
Conifères en décompositionColeopteraActium n.sp.
Dans les zones tourbeuses des
vieilles pessières
ColeopteraPlatynus mannerheimii (Dejean)
Sous les écorces de Picea
mariana Mill. BSP
ColeopteraAtrecus macrocephalus (Nordmann)
Famille
Buprestidae
Cerambycidae
Tipulidae
Ptiliidae
Mycetophagidae
Staphylinidae : Pselaphinae
Carabidae
Staphylinidae
Tableau 1. Principales caractéristiques des huit espèces étroitement liées aux forêts boréales matures et anciennes.
Pierre Paquin est entomologiste et candidat au Ph. D.
à l’Université de Montréal.
Introduction
Depuis la récente prise de conscience face à la dis-
parition d’espèces de la surface du globe, on assiste à de
nombreux débats sur l’importance à donner aux divers
éléments qui composent la diversité biologique et sa con-
servation. En se basant sur le degré de fragilité de certaines
espèces, il est proposé d’accorder une priorité élevée à la
faune inféodée aux habitats qui sont menacés de dispari-
tion à brève échéance (Caldecott et al., 1996). Dans la forêt
boréale, cette préoccupation touche directement les peuple-
ments anciens et matures car la normalisation des classes
d’âge, qualifiée de souhaitable par l’industrie (voir Barette et
al., 1996), entraîne la raréfaction de ces forêts (Gauthier et
al., 1997a) et pourrait provoquer leur disparition. Du point
de vue de la conservation, la question qui découle de cette
situation est simple : existe-t-il des espèces, végétales ou ani-
males, qui se trouvent uniquement dans les stades âgés de
la forêt boréale ? Une intense campagne d’échantillonnage
menée en Abitibi a permis d’identifier huit espèces d’insectes
qui semblent étroitement liées aux stades matures et anciens
de la forêt boréale (tableau 1). Ces espèces sont présentées ici
de même que quelques aspects liés à l’influence de la matu-
ration forestière sur la diversité entomologique.
La maturation de la forêt boréale
Une caractéristique remarquable de la forêt boréale
est sa structure dite en mosaïque, qui résulte de diverses
perturbations naturelles parmi lesquelles les feux ont une
importance majeure (Rowe et Scotter, 1973). Une telle hété-
rogénéité du paysage s’explique par la présence simultanée
de différents stades de succession forestière, dont l’âge et la
composition en espèces dépendent surtout du temps écoulé
depuis le dernier incendie forestier. Les feux de forêts sont
perçus comme le point de départ de la succession forestière et
l’ensemble du processus de vieillissement (des peuplements
brûlés jusqu’aux stades de sénescence) est appelé maturation
forestière.
Huit espèces d’insectes associées aux
forêts matures et anciennes
Pierre Paquin

116
LA SOCIÉTÉ PROVANCHER D’HISTOIRE NATURELLE DU CANADA
LES INSECTES
(S)
Âge de la forêt
Feux de forêts Forêts matures
A
B
Forêts anciennes
C
Figure 1. Variation du nombre d’espèces, (S), en fonction des stades de la maturation forestière.
Dans la forêt boréale mixte, les espèces arborescen-
tes se succèdent en fonction de l’âge des peuplements ; les
plus jeunes stades sont dominés par les essences feuillues
comme les peupliers, tandis que les conifères dominent dans
les stades plus âgés. Sur les rives du lac Duparquet, les cédriè-
res à sapin composent les stades les plus avancés de la succes-
sion et atteignent plus de 230 ans (Dansereau et Bergeron,
1993). Plus au nord, la situation diffère puisque l’épinette
noire domine tous les stades de la succession écologique qui
se déroule à la suite des incendies forestiers. Les peuplements
les plus âgés trouvés dans la région située au nord de LaSarre
atteignent 340 ans.
Effet de l’âge du système forestier sur la
diversité entomologique
La maturation d’un écosystème comme la forêt
boréale produit deux effets sur la diversité entomologique.
Premièrement, le vieillissement influence la richesse spé-
cifique, c’est-à-dire le nombre d’espèces rencontrées. Basé
sur l’étude des communautés des Carabidae des pessières
boréales, Paquin propose un nouveau modèle écologique de
l’influence du temps sur la richesse, qui démontre une aug-
mentation du nombre d’espèces dans les stades sénescents de
la succession végétale (figure 1). La maturation forestière n’a
pas seulement un effet sur le nombre d’espèces rencontrées,
mais on assiste aussi à un remplacement graduel des espèces
pionnières par des espèces caractéristiques des stades plus
âgés. On observe un changement de la composition en espè-
ces en fonction de l’âge de la forêt, et l’assemblage d’espèces
trouvé dans les forêts anciennes diffère de celui des autres
stades de développement.
Comment expliquer l’augmentation du nombre
d’espèces et les changements observés dans la composition
spécifique ? Selon ce modèle, des espèces associées étroite-
ment à certaines ressources et à des microhabitats qui ne
se trouvent que dans les stades de maturation avancés (illus-
trées par la portion c du graphique) s’ajoutent aux espèces
forestières présentes dans les stades matures (courbe b), ce
qui résulte en une augmentation de la richesse et en une com-
position spécifique propre aux forêts anciennes (courbe a).
Le bois mort : la clé de la diversité
Outre l’âge avancé des arbres, le principal facteur qui
distingue les forêts anciennes est l’accumulation de matière
végétale morte. En effet, la maturation forestière est asso-
ciée à une accumulation de débris sous forme de feuilles
et d’aiguilles qui sont décomposées et incorporées dans les
horizons organiques du sol (Minderman, 1968). Cependant,
c’est sous la forme ligneuse que cette accumulation est la
plus importante, la quantité de débris ligneux morts (coarse
woody debris) augmentant en fonction du degré de matura-
tion de la forêt (Harmon et al., 1986). Les forêts anciennes
sont caractérisées par une remarquable variabilité de clas-
ses de décomposition du bois mort (Harmon et al., 1986 ;

117
LE NATURALISTE CANADIEN, VOL. 125 No 3 AUTOMNE 2001
LES INSECTES
Cédrière à sapin sur les rives du lac Duparquet.
PIERRE
PAQUIN
Spies et al., 1988 ; Tyrrell et Crow 1994 ; Green et Peterken
1997). Or, les insectes et les différents arthropodes associés
à la matière organique morte sont plus diversifiés et abon-
dants que ceux associés à la matière vivante (Nilsson et al.,
1995). L’importance des débris ligneux morts est telle qu’elle
constitue le point central de la problématique des forêts
anciennes et de la conservation des espèces qui y sont asso-
ciées (Harmon et al., 1986 ; Samuelsson et al., 1994). En Scan-
dinavie, par exemple, on compte près de 1 000 espèces de
coléoptères qui dépendent directement du bois mort pour
leur survie (Ås, 1993 ; Nilsson et Baranowski, 1994, 1997),
ce qui représente jusqu’à 20 % de l’entomofaune de Suède
(Bader et al., 1995).
Selon le modèle proposé, l’augmentation de la diversité
en microhabitats dans les phases dites matures et anciennes
dépend essentiellement du bois mort et de sa décomposition.
Les débris ligneux remplissent à ce titre trois rôles distincts :
1) ils peuvent être une source directe de nourriture, car
certains insectes se nourrissent exclusivement de bois mort ;
2) ils peuvent être le substrat pour d’autres formes de vie
comme les champignons et les lichens, qui, à leur tour,
sont une source de nourriture pour des espèces spécialistes
et, finalement, 3) le bois mort constitue une forme d’ha-
bitat particulier dans lequel se trouvent des prédateurs
spécialisés.
Espèces rares, forêts matures et anciennes
Il faut souligner que les espèces spécialistes des forêts
âgées sont rarement abondantes. Sauf pour quelques cas
qui ont fait l’objet d’une attention dirigée, la plupart des
espèces mentionnées ici ont été récoltées en peu d’exem-
plaires. Il est alors difficile de démontrer une relation
statistiquement soutenue de leurs affinités pour les habitats
anciens, mais il s’agit d’une difficulté inhérente à l’étude
des espèces rares. Les mentions rapportées ici s’appuient sur
nos récoltes et sont étayées par des données tirées de la litté-
rature. À la lumière des connaissances actuelles, elles sont
qualifiées d’espèces spécialistes des forêts boréales matures
et anciennes.
Arbres morts : source de nourriture
Les deux premières espèces présentées appartiennent
aux familles des Cerambycidae et Buprestidae qui sont des
coléoptères xylophages, c’est-à-dire qui se nourrissent du
bois des arbres. Les cérambycidés comptent 177 espèces au
Québec et bien qu’il y ait quelques généralistes des conifères
ou des bois durs, la plupart des espèces sont inféodées à quel-
ques essences végétales précises. Les femelles adultes recher-
chent un arbre mort ou mourant d’une espèce précise pour
y pondre leurs œufs et où se développeront les larves. Ainsi,
dans la forêt boréale mixte qui entoure le lac Duparquet,

118
LA SOCIÉTÉ PROVANCHER D’HISTOIRE NATURELLE DU CANADA
LES INSECTES
Forêt d’épinettes noires âgée de plus de trois cent ans dans laquelle on observe une réouverture du couvert
et une importante accumulation de débris ligneux
PIERRE
PAQUIN
nous avons récolté Callidium violaceum (Linné), dont les
larves se nourrissent exclusivement du bois du cèdre blanc,
Thuya occidentalis Linné. Comme cette essence se trouve
dans les stades les plus âgés de la succession végétale, par
association, C. violaceum est inféodé à cette phase de la matu-
ration forestière. Toutefois, les cèdres morts ou mourants ne
sont pas fréquents dans ces peuplements, car le cèdre blanc
peut vivre jusqu’à 1 000 ans dans certaines conditions. La
cohorte de cèdres trouvée à cet endroit est donc relativement
jeune et ne démontre pas de signes de dépérissement, ce qui
ne favorise pas la prolifération de C. violaceum.
La seconde espèce, Melanophila abies Champlain &
Knull, est un bupreste qui n’était connu que par quelques
mentions au Canada. Les récoltes dans les pessières âgées
d’Abitibi suggèrent que cette espèce se développe sur l’épi-
nette noire (Picea mariana Mill. BSP) car, jusqu’à présent,
on ne lui connaissait que le sapin beaumier (Abies balsamea
(L.) Mill.), comme hôte. Bright (1987) rapporte qu’il subsiste
un doute sur l’identité de cette espèce que certains croient
n’être qu’une variation de Melanophila drummondi drum-
mondi (Kirby). Les spécimens d’Abitibi ont été identifiés
selon les connaissances taxonomiques actuelles (qui distin-
guent ces deux taxons) et des exemplaires des deux espèces,
M. abies et M. d. drummondi, ont été récoltés. Toutefois, tous
les exemplaires de M. d. drummondi proviennent des stades
de succession où l’on trouve des épinettes noires mortes à
la suite d’incendies forestiers. Il semble donc que ces deux
espèces congénériques occupent des niches écologiques qui
se distinguent dans le gradient d’âge de la succession végétale
de la pessière noire. Melanophila d. drummondi préférerait
les épinettes noires mortes du début de la succession, tandis
que M. abies opterait plutôt pour les épinettes mortes ou
mourantes des stades anciens de la succession.
Arbres morts : substrat recherché
Il n’y a pas que les insectes qui recherchent le bois mort ;
des organismes comme les champignons ont développé
une étroite relation avec certaines essences d’arbres
morts sur lesquels ils se développent. Ces champignons
sont aussi les hôtes d’organismes spécialisés et la découverte
du coléoptère Cylindroselloides dybasi Hall (Ptiliidae) au
Québec (Paquin et Dupérré, 2000) révèle un bel exemple
d’une association écologique propre aux forêts matures et
anciennes. D’une longueur de 0,45 mm, le plus petit coléop-
tère du Canada, C. dybasi, est étroitement associé au
polypore Fomitopsis pinicola (Schwarts : Fr.) Karst et, comme
toutes les espèces de la tribu des Nanosellini, il vit exclu-
sivement dans les microtubules de ce polypore. Dans les
pessières boréales, la présence de F. pinicola est étroitement
liée à deux variables qui sont dépendantes de l’âge des forêts :

119
LE NATURALISTE CANADIEN, VOL. 125 No 3 AUTOMNE 2001
LES INSECTES
1) ce polypore pousse sur les épinettes mortes dont l’écorce
est encore présente et 2) dans certaines conditions d’humi-
dité, qui sont assurées par la présence d’un couvert végétal.
La combinaison de ces deux facteurs (substrat et couvert
végétal) est optimale dans les phases matures et anciennes de
la succession végétale, ce qui confère à F. pinicola et son hôte
spécialiste, C. dybasi, le statut d’organismes spécialistes des
forêts âgées (Paquin, soumis b).
L’échantillonnage de la faune associée au poly-
pore F. pinicola a permis de récolter le rarissime Thrimolus
minutus Casey (Mycetophagidae). Il s’agit de la deuxième
mention de cette énigmatique espèce au Canada, ce qui étend
sa répartition géographique connue de plus de 700 km vers
le nord. Il y a de bonnes raisons de croire que cette espèce,
qui appartient à une famille qui se nourrit exclusivement de
champignons, démontre des affinités écologiques sembla-
bles à celles observées chez C. dybasi. Toutefois, il est plus
prudent de l’inclure dans la liste en apposant une réserve qui
indique que des données supplémentaires sur cette espèce
rare sont souhaitables.
Il va sans dire que les étroites associations entre
les champignons et certaines espèces spécialistes méritent
d’être approfondies dans le contexte des espèces inféodées
aux forêts matures et anciennes. Plusieurs coléoptères sont
mycophages et il ne serait pas surprenant de découvrir
d’autres associations de ce type, voire même de nouvelles
espèces, dans les familles des Leiodidae, Mycetophagidae,
Ptiliidae et Endomychidae. De plus, les associations entre
insectes et champignons ne sont pas exclusives aux colé-
optères : certains diptères comme les Mycetophilidae sont
aussi mycophages. Dans une étude réalisée en Norvège,
cette famille a démontré une étonnante réponse spécifique
à la maturation forestière (Økland, 1994) mais, à ce jour,
personne n’a étudié les Mycetophilidae des forêts boréales
nord-américaines.
Habitats spécialisés dans les
forêts matures et anciennes
Dans les pessières noires de l’Abitibi, les arbres attei-
gnent la maturité après une période de croissance d’envi-
ron une centaine d’années et c’est surtout à partir de cette
période que débute la sénescence des plus vieux arbres. En
plus de constituer une source directe de nourriture ou un
substrat spécialisé pour des organismes comme les champi-
gnons, les arbres morts forment un habitat dans lequel des
prédateurs spécialistes trouvent leur nourriture. Le premier
cas d’une espèce associée aux microhabitats créés par les
arbres morts est celui d’Atrecus macrocephalus (Nordmann),
un staphylin que nous avons récolté dans les vieilles pessières.
Cette espèce se spécialise dans la prédation sous les écorces
des épinettes mortes. Cette spécialisation est par ailleurs bien
connue (Smetana, 1982), car A. macrocephalus arbore une
morphologie parfaitement adaptée à ce type de microhabi-
tat ; il est très fortement aplati dorso-ventralement, ce qui lui
permet de circuler dans l’interstice entre le bois et l’écorce
des épinettes récemment mortes. La plupart des staphylins
sont des prédateurs généralistes associés aux sols forestiers
où cohabitent une foule d’organismes. Pourquoi A. macroce-
phalus se trouve-t-il dans un habitat aussi particulier que les
dessous des écorces ? Sans doute que la pression compétitive
avec les autres espèces de prédateurs est beaucoup moins
grande dans un habitat où sa morphologie spécialisée lui
procure un avantage certain.
Une autre espèce de prédateur spécialiste des dessous
d’écorce a été récoltée dans les pessières d’Abitibi. Il s’agit du
carabe Tachyta angulata Casey qui présente aussi une mor-
phologie parfaitement adaptée à ce microhabitat. Contrai-
rement à A. macrocephalus qui ne se trouve que dans les forêts
matures et anciennes, T. angulata se rencontre également
dans les forêts récemment brûlées, le point de départ de la
succession, où se trouvent beaucoup d’épinettes mortes à
cause du feu. Ces deux espèces occupent des niches écologi-
ques semblables, mais qui se distinguent dans le gradient
d’âge de la pessière puisqu’A. macrocephalus est une espèce
qui ne se rencontre pas dans les forêts récemment brûlées.
Après la mort de l’épinette noire et la chute du tronc
au sol, il se produit une lente décomposition avec le concours
de divers micro-organismes comme les bactéries et les cham-
pignons. Lors des étapes de décomposition caractérisées par
l’aspect plus spongieux des troncs, on assiste à la proliféra-
tion de petits arthropodes qui vivent dans ces troncs pourris.
Les acariens oribates forment un important groupe d’orga-
nismes associé à cette phase de décomposition. Malgré leur
petite taille, ils remplissent un rôle écologique de premier
plan en propageant et en inoculant ces bactéries et ces cham-
pignons. Bien que de nombreuses espèces d’oribates soient
probablement inféodées aux forêts anciennes, nous nous
attarderons plutôt à une espèce de coléoptère qui appartient
aux Pselaphinae, une sous-famille prédatrice des acariens
oribates. Ainsi, une nouvelle espèce a été découverte dans les
stades les plus âgés (230 ans et plus). Cette espèce est connue
uniquement de l’Abitibi où elle est trouvée dans les billots
pourris de conifères. Cette espèce est très rare et probable-
ment endémique aux forêts boréales nordiques âgées. Elle
appartient au genre Actium et sera décrite sous peu (avec la
collaboration de Donald Chandler de l’Université du New
Hampshire).
Le dernier cas de microhabitat propre aux forêts
boréales anciennes et d’une espèce d’insecte qui y est associée
est celui du carabe Platynus mannerheimii (Dejean). Con-
trairement aux espèces citées précédemment, P. mannerhei-
mii ne dépend pas du bois mort mais plutôt des conditions
particulières liées aux sols forestiers des vieilles pessières
(Biström et Väisänen, 1988). Lindroth (1966) mentionne
que cette espèce est typique des habitats tourbeux. Niemelä
et al. (1987) ont, quant à eux, précisé que P. mannerheimii est
 6
6
 7
7
1
/
7
100%