Lire l'article complet

ReVue De PReSSe coordonné par
le Pr B. Combe
12 | La Lettre du Rhumatologue • No 379-380 - février-mars 2012
Modification du répertoire des anticorps antiprotéines citrullinées
AVANT l’apparition de la polyarthrite rhumatoïde
L’épitope est le déterminant antigénique ou un site à la surface de la molécule antigénique
sur lequel se fixe l’anticorps spécifique. Il s’agit généralement d’une séquence peptidique
de petite taille. Chaque antigène a plusieurs épitopes, qui réagissent avec des anticorps de
différentes spécificités et affinités. Certains de ces épitopes sont cachés ou cryptiques, ou
localisés dans des zones non accessibles au système immunitaire (sperme, cristallin, etc.). Ils
nécessitent parfois des modifications conformationnelles ou stéréochimiques pour entraîner
une réaction du système immunitaire. Le terme d’“epitope spreading” (ES) désigne le déve-
loppement d’une réponse immunitaire dirigée contre des épitopes distincts de l’épitope
dominant, et ceci sans phénomène de réactivité croisée(1). En auto-immunité, il s’agit du
développement d’une réponse envers des épitopes endogènes. La réponse peut s’étendre
(traduction littérale d’epitope spreading) dans un second temps à différents épitopes, soit
sur une molécule, soit sur des protéines différentes, et permet ainsi à l’organisme d’étendre
sa réponse immune à d’autres cibles grâce à cette diversification. Ce phénomène est
connu dans la réponse contre les cancers mais également dans les infections (VIH, Borrelia
burgdorferi, vaccination, etc.).
Dans la polyarthrite rhumatoïde (PR), les anticorps antiprotéines citrullinées (ACPA) sont
présents chez 70 % des patients. Ils contribuent également au développement de la maladie
dans des modèles murins. Chez l’adulte, les ACPA peuvent être présents avant le début de
la maladie(2). Par ailleurs, la présence d’ACPA chez des patients ayant des arthralgies est
un facteur prédictif d’évolution vers une PR. Chez ces patients, il existe une réactivité dirigée
contre différents peptides citrullinés. Dans cette étude, les auteurs ont voulu démontrer qu’il
existait également dans la PR un phénomène auto-immun évolutif impliquant une modifi-
cation des spécificités antigéniques au cours du temps, avant même le déclenchement de
la maladie. L’étude a été menée sur des patients atteints d’une PR qui avaient été donneurs
de sang au préalable. La qualité de conservation des sérums a été analysée, et 70donneurs
sains ont été appariés pour l’âge et le sexe. Pour chaque patient, le dernier sérum disponible
avant la date de diagnostic de la PR a été analysé. Les ACPA ont été mesurés par un test
Elisa classique de type anti-CCP2 (Axis-Shield). Les facteurs rhumatoïdes de type IgM ont
100
80
60
20
40
015 10 5 0
Patients ACPA+ (%)
Années avant le diagnostic de PR
1
2
4
3
5
n = 53
4
3
1
2
014 10111213 56789 1234 0
Nombre moyen de peptides
Années avant le diagnostic de PR
n = 2 5 5 6 10 13 14 27 34 36 32 34 38 42 37
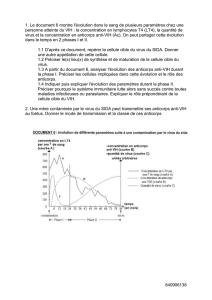
Figure 1. Pourcentage cumulé de patients atteints de PR et ayant une
réactivité aux différents peptides citrullinés testés (1, 2, 3, 4 ou 5) pour
chaque patient ACPA+ (n = 53).
Figure 2. Nombre médian de peptides reconnus par les patients atteints
de PR au cours du temps avant le diagnostic de PR. Le temps 0 correspond
à 1 an avant le diagnostic.
LR379-NN-1901_V2.indd 12 09/03/12 12:43

ReVue De PReSSe
La Lettre du Rhumatologue • No 379-380 - février-mars 2012 | 13
été dosés par un test propre au laboratoire qui réalisait l’Elisa. La réactivité à 5 peptides
citrullinés a été évaluée : 1peptide cyclique dérivé de la filaggrine (CCP1), 2peptides dérivés
du fibrinogène : cFib1 (chaîne β, acides aminés 36-52) et cFib3 (chaîneα, acides aminés
36-50), un peptide citrulliné non cyclique dérivé de l’α-énolase (cEno) et un peptide dérivé
de la vimentine (cVim). Les sérums ont aussi été testés pour leur réactivité en Elisa à ces
5peptides non citrullinés (peptides de type arginine). Tous ces tests ont été validés par les
auteurs, qui ont déterminé les seuils de significativité et de positivité. Dans une cohorte
de 80 PR témoins, ils ont retrouvé des anticorps anti-CCP2 chez 70 % des patients, des
anti-CCP1 chez 58 %, des anti-cEno chez 61 %, des anti-cFib1 chez 68 %, des anti-cFib3
chez 46 % et des anti-cVim chez 59 %.
Au total, 79patients(62 % de femmes) atteints de PR selon les critères de l’ACR 1987 ont
été inclus ; 53 étaient ACPA+ et 26 ACPA−. Le temps médian entre le début des symptômes
et le diagnostic de PR était de 12mois ; 67 % des patients avaient des anti-CCP2 ou au
moins une réactivité à l’un des peptides testés avant le diagnostic de PR. Dans le groupe
des 53patients ACPA+, 374 échantillons de sérum prélevés avant le diagnostic de PR ont
pu être retrouvés ; seuls ceux de 4patients ne présentaient aucune réactivité aux 5peptides
testés, tandis que ceux de 16patients(30 %) présentaient une réactivité aux 5. Vingt-cinq
patients séronégatifs sont devenus séropositifs. Pour chacun des patients qui étaient ACPA+
avant le diagnostic de PR, le premier sérum ayant une réactivité à un peptide citrulliné a
été identifié. Dix-huit de ces 25patients(72 %) présentaient une réactivité à 1 peptide,
2(8 %) à 2peptides, et aucun n’en présentait aux 5 sur ce premier sérum. En revanche,
le nombre de peptides reconnus augmentait progressivement à l’approche du diagnostic
de PR (figure 1). Initialement, cette réactivité était principalement dirigée contre cFib1
et la majorité des patients n’avait pas de facteurs rhumatoïdes de type IgM. La réactivité
aux anticorps, qui était initialement dirigée essentiellement contre un seul épitope, s’est
étendue progressivement à plusieurs épitopes (figure 2) : 74 % des patients avaient une
réactivité dirigée contre cFib1, 66 % contre cVim, 58 % contre CCP1, 57 % contre cEno et
45 % contre cFib3. Au cours du temps, 27patients(51 %) sont devenus positifs pour les
facteurs rhumatoïdes de type IgM.
V. Devauchelle-Pensec (Brest)
Commentaire
En conclusion, la réactivité aux peptides citrul-
linés préexiste au développement de la PR. Par
ailleurs, un phénomène d’“epitope spreading”,
avec une réactivité antigénique initialement plutôt
restreinte mais qui s’étend progressivement à
l’approche du développement de la PR, semble
se produire. Le rôle délétère de cette diversifica-
tion antigénique n’a toutefois pas été clairement
démontré. La question de la recherche non pas
d’un seul épitope mais d’un épitope dominant
entraînant une réactivité à plusieurs autres anti-
gènes se pose donc à nouveau.
Référence bibliographique
Van de Stadt LA, de Koning MHMT, Van de Stadt RJ et al.
Development of the anti-citrullinated protein antibody
repertoire prior to the onset of rheumatoid arthritis.
Arthritis Rheum 2011;63:3226-33.
Références complémentaires
1. Lehmann PV, Forthruber T, Miller A, Sercarz EE. Spreading
of T cell autoimmunity to cryptic determinants of an auto-
antigen. Nature 1992;358:155-7.
2. Nielen MM, Van Schaardenburg D, Reesink HW et al.
Specific autoantibodies precede the symptoms of rheuma-
toid arthritis: a study of serial measurements in blood donors.
Arthritis Rheum 2004;50(2):380-6.
Les patients ne répondant pas à l’étanercept
ont des concentrations sériques médicamenteuses
plus basses que les patients répondeurs
L’objectif de cette étude était de regarder s’il existe une corrélation entre les concentrations
sériques d’étanercept et la réponse clinique au traitement chez les patients atteints de
polyarthrite rhumatoïde (PR). Pour cela, les auteurs ont analysé le sérum de 292patients
avant le traitement puis à 1, 4 et 6mois. Tous les patients recevaient, en 1 ou 2injections,
50mg/sem. d’étanercept en sous-cutané. À tous les temps étudiés, les forts répondeurs
selon les critères EULAR avaient des concentrations sériques d’étanercept plus élevées que
les patients ayant une réponse moyenne ou nulle (concentrations médianes respectives à
6mois : 3,78mg/l [interquartile :2,53-5,17] ; 3,10 [2,12-4,47] et 2,80 [1,27-3,93] ; p<0,05).
Parmi les patients appartenant au quartile ayant l’étanerceptémie la plus basse (<2,1mg/l),
il y avait 40 % de l’ensemble des non-répondeurs. Les patients ayant les concentrations
d’étanercept les plus basses étaient le plus souvent des femmes (89 % dans le quartile le
plus bas, contre 68 % dans le quartile le plus élevé ; p=0,002), ils utilisaient des doses de
méthotrexate plus faibles (12,6±9,9mg/sem. contre 16,9±10,0 ; p=0,01), avaient un
indice de masse corporelle plus élevé (27,5±6,3 kg/m2, contre 24,9±4,3 ; p=0,007) et
un taux de filtration glomérulaire plus haut (130,0±46,6 ml/mn, contre 107,8±29,4 ;
p=0,001). Aucun anticorps anti-étanercept n’a été retrouvé dans cette étude.
C. Immediato-Daien (Montpellier)
Commentaire
Si l’association entre des concentrations médica-
menteuses basses et l’absence de réponse clinique
est bien connue pour l’infliximab et l’adalimumab,
il s’agit du premier travail montrant cette relation
pour l’étanercept, ce qui soulève la question de
l’intérêt d’une augmentation des doses chez des
patients non répondeurs avec une étanerceptémie
basse. Par ailleurs, les concentrations d’étaner-
cept n’étant pas liées au développement d’anti-
corps antimédicaments et semblant relativement
stables, elles pourraient peut-être aider à prédire
la réponse au traitement.
Référence bibliographique
Jamnitski A, Krieckaert CL, Nurmohamed MT et al. Patients
non-responding to etanercept obtain lower etanercept
concentrations compared with responding patients. Ann
Rheum Dis 2012;71:88-91.
LR379-NN-1901_V2.indd 13 09/03/12 12:43

REVUE DE PRESSE coordonné par
le Pr B. Combe
14 | La Lettre du Rhumatologue • No 379-380 - février-mars 2012
Diminution de la réponse B spécifique dirigée
contre le virus influenza chez les patients atteints
de polyarthrite rhumatoïde traités par anti-TNF
Le risque infectieux est plus grand chez les patients atteints de polyarthrite rhumatoïde (PR) que
dans la population générale, particulièrement si ces patients sont traités par anti-TNF. Une des
hypothèses pouvant expliquer cette plus grande susceptibilité infectieuse pourrait être une plus
faible réponse humorale entraînée en partie par l’activité du rhumatisme mais aussi par les consé-
quences du blocage de la voie du TNF. En effet, le TNF est connu pour jouer un rôle important
dans le développement et l’homéostasie du répertoire B ainsi que dans ses capacités de réponse
aux antigènes, notamment par l’activation de la voie NF-κB après liaison du TNF à ses récepteurs.
Deplus, le TNF participe à l’organisation des centres germinatifs via l’activation des cellules dendri-
tiques folliculaires, son blocage y provoquant alors des perturbations fonctionnelles majeures (1).
Les centres germinatifs étant indispensables au déclenchement de la production d’anticorps, le
blocage du TNF pourrait de fait altérer la fonction effectrice et la fonction mémoire des cellules B,
contribuant ainsi à l’augmentation du risque d’infections et à une faible réponse aux vaccinations.
Pour le démontrer, J.J. Kobie et al. (université de Rochester, États-Unis) ont étudié puis comparé
les réponses B antigrippales postvaccinales précoce (<10jours) et mémoire (>1mois) de
164patients atteints de PR, dont certains étaient traités par méthotrexate (MTX) et/ou anti-
TNF, et de 97 volontaires sains servant de témoins.
Après toute vaccination s’observe une réponse B effectrice transitoire où des cellules B préplas-
mocytaires CD19+ IgD− CD27hi CD38hi gagnent le sang périphérique. Leur taux est fortement
corrélé à celui des anticorps spécifiques antigrippaux qui seront ensuite synthétisés. Dans
cette étude, les taux sériques postvaccinaux (vaccin saisonnier inactivé dirigé contre 3 souches
grippales) d’anticorps anti-influenza ont été mesurés tous les ans pendant au moins 2ans, de
2006 à 2010, dans les 10jours puis 1 et 6mois après la vaccination, de même que les taux de
cellules préplasmocytaires exprimant en surface des anticorps spécifiquement dirigés contre le
virus influenza ainsi que les taux des cellules B mémoires correspondantes.
J.J. Kobie et al. ont ainsi montré que les patients atteints de PR et traités par anti-TNF produisaient
des anticorps anti-influenza en réponse à leur vaccination. Cependant, ces patients en produi-
saient significativement moins que les sujets sains et que les patients ne recevant pas d’anti-TNF
(figure), tant à 1mois (50 %, 65 % et 30 % moins d’anticorps anti-influenza H1N1, H3N2 et
B respectivement) qu’à 6mois
après la vaccination.
De même, leur taux de
cellules B mémoires était
lui aussi significativement
réduit, ainsi que la réponse
B spécifique anti-influenza à
court terme, avec significa-
tivement moins de cellules
B préplasmocytaires CD19+
IgD− CD27
hi
CD38
hi
chez
les patients atteints de PR et
traités par anti-TNF que chez
les volontaires sains ou que
chez les patients atteints de
PR ne recevant pas d’anti-TNF.
Cela était également corrélé
à une diminution significa-
tive des taux de cellules B
mémoires spécifiques.
V. Goëb (Rouen)
Commentaire
Ce travail montre que les patients atteints de PR et
traités par anti-TNF produisent des anticorps anti-
influenza après vaccination à des taux présumés
suffisants pour leur conférer une séroprotection
antivirale efficace. Néanmoins, ces patients pré-
senteraient une réponse immune humorale post-
vaccinale moins efficace du fait d’une moindre
réponse B effectrice et mémoire, aboutissant à une
production d’anticorps réduite. L’augmentation de
l’incidence et de la sévérité des infections observée
chez ces patients traités par anti-TNF pourrait être
la conséquence d’une capacité de réponse initiale
à l’antigène diminuée. Ce travail corrobore celui
de L.B.Gelinck et al. (2) et de J.L. Kaine et al. (3),
qui ont déjà observé une plus faible efficacité de la
vaccination antigrippale chez les patients atteints
de PR et traités par anti-TNF. Cependant, il va contre
les résultats d’une étude de la réponse vaccinale
anti-H1N1 chez des patients atteints de rhumatismes
inflammatoires chroniques (4), où il n’a été relevé
aucune influence négative des traitements anti-TNF,
au contraire du MTX ou du rituximab reçu dans les
3mois précédant la vaccination.
En l’absence de contre-indication particulière, la
vaccination saisonnière antigrippale des patients
traités par anti-TNF est à encourager annuellement
et selon les mêmes modalités que pour la popula-
tion générale, conformément aux recommandations
actuelles de la Société française de rhumatologie
(5). Si d’autres études confirmaient les résultats de
J.J.Kobie et al., des schémas de vaccination saison-
nière – mais avec rappel systématique et/ou utili-
sation de vaccins antigrippaux plus immunogènes
(couplés avec des adjuvants) – pourraient être des
solutions pratiques à envisager pour optimiser l’effi-
cacité vaccinale chez ces patients.
Référence bibliographique
Kobie JJ, Zheng B, Bryk P et al. Decreased influenza-specific
B cell responses in rheumatoid arthritis patients treated with
anti-TNF. Arthritis Res Ther 2011;13:R209 [Epub ahead of print].
Références complémentaires
1. Anolik JH, Ravikumar R, Barnard J et al. Cutting edge: anti-
tumor necrosis factor therapy in rheumatoid arthritis inhibits
memory B lymphocytes via effects on lymphoid germinal
centers and follicular dendritic cell networks. J Immunol
2008;180:688-92.
2. Gelinck LB, Van der Bijl AE, Beyer WE et al. The effect of anti-
tumour necrosis factor α treatment on the antibody response
to influenza vaccination. Ann Rheum Dis 2008;67:713-6.
3. Kaine JL, Kivitz AJ, Birbara C, Luo AY. Immune responses
following administration of influenza and pneumococcal
vaccines to patients with rheumatoid arthritis receiving
adalimumab. J Rheumatol 2007;34:272-9.
4. Gabay C, Bel M, Combescure C et al.; H1N1 Study Group.
Impact of synthetic and biologic disease-modifying antirheu-
matic drugs on antibody responses to the AS03-adjuvanted
pandemic influenza vaccine: a prospective, open-label, parallel-
cohort, single-center study. Arthritis Rheum 2011;63:1486-96.
5. Pham T, Bachelez H, Berthelot JM et al. TNF alpha anta-
gonist therapy and safety monitoring. Joint Bone Spine
2011;78(Suppl. 1):15-185.
512
256
128
32
64
16
80,0 0,2 0,4 0,6 0,8 1,0
Taux d’anticorps anti-influenza
(dilutions moyennes observées)
Temps (0-1 mois)
* Différence significative avec les témoins sains.
** Différence significative avec les patients atteints de PR.
Témoins sains (n = 14-24)
Patients atteints de PR (n = 5-7)
Patients atteints de PR traités par MTX (n = 3-13)
Patients atteints de PR traités par anti-TNF (n = 7-13)
*
** **
Figure. Comparaison de l’évolution des taux postvac-
cinaux d’anticorps anti-influenza au cours du temps.
LR379-NN-1901_V2.indd 14 09/03/12 12:43
1
/
3
100%