Organisation du végétal

1
La diversité morphologique des végétaux, la
morphogénèse, la mitose
1

2
La diversité morphologique des végétaux

3
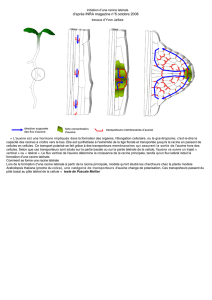
Organisation du végétal
apex d’une
racine
Appareil
aérien (tige et
feuilles) bourgeon axillaire
limbe
racines
un entrenoeud
bourgeon
terminal
Appareil
racinaire
souterrain
Chaque espèce possède :
-un appareil végétatif (tige, feuilles, racines)
-un appareil reproducteur (fleurs et fruits),
-un appareil aérien et un appareil souterrain.
La forme, la taille, la couleur, l’organisation dans l’espace de ces appareils déterminent
la morphologie du
végétal qui lui est spécifique.

4
•Le hêtre est un arbre pouvant atteindre jusqu’à 40 m de hauteur.
Comme on peut le voir sur la photographie, la couronne des jeunes
arbres est élancée, conique plutôt frêle ; celle des plus vieux forme
un immense dôme . Les feuilles sont simples, non dentées, mais avec
une bordure « poilue ». Elles sont disposées en alternance le long
des rameaux .
Morphologie végétale et identification des espèces
1- Morphologie végétale et identification des espèces
Sur le terrain, l’identification des différentes espèces végétales repose sur le partage par
tous les individus de la même espèce d’un ensemble de caractéristiques
morphologiques : port général de la plante, disposition des feuilles, caractéristiques des
feuilles et des fleurs . L’utilisation de ces caractéristiques morphologiques est à la base
des divers guides d’identification des végétaux.
4

5
•L’ajonc est un arbuste au port
buissonnant, velu, pouvant
atteindre 2,5 m de hauteur.
Ses rameaux sont piquants,
hérissés de feuilles en aiguilles.
Ses fleurs sont jaunes. L’ajonc
est une espèce très abondante
dans l’ouest de la France.
Port buissonnant ou arbusif
La forme des feuilles, des racines, des tiges permet de distinguer les espèces entre elles.
La disposition relative des différents organes (tiges, feuilles, racines) constitue le port
végétal.
Le port arborescent caractérise les plantes qui ont un tronc et un houppier bien
distincts.
Le port arbustif caractérise les plantes qui ont des branches ramifiées avec peu ou pas
de tronc. Ces plantes ont uneTige ramifiée dès sa base ne dépassant pas les 5 m. Il n’y a
pas de tige principale individualisée
Le port herbacé caractérise les plantes qui n’ont pas de parties ligneuses (bois). Il est
formé d’une tige feuillée verte et souple ne dépassant pas les 30 cm.
La construction du port du végétal (= morphogenèse) se met en place à partie de
territoires spécifiques (=les méristèmes) de la plante situés aux extrémités (apex) des
tiges et des racines.
C’est à ces niveaux que les gènes contrôlant la morphogenèse s’expriment.
Comme chez les animaux les végétaux possèdent des gènes de développement, mais
qui s’expriment tout au long de la vie plante.
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
1
/
74
100%