Avancées technologiques et nouveaux fractionnements Technical improvements and hypofractionation

dossier thématique
Radiothérapie du cancer
de la prostate localisé
Correspondances en Onco-Urologie - Vol. III - no 3 - juillet-août-septembre 2012
9696
Avancées technologiques
et nouveaux fractionnements
Technical improvements and hypofractionation
M. Deberne*, P. Giraud*
* Service d’oncologie-
radiothérapie,
hôpital européen
Georges-Pompidou, Paris.
L
es nouvelles techniques de radiothérapie visent
à obtenir une irradiation de haute précision inté-
grant dans la procédure de traitement les derniers
développements technologiques, au prix cependant
d’une grande complexité. L’objectif est d’obtenir un
traitement “hautement conformationnel”, c’est-à-dire
de diminuer la dose administrée aux organes sains,
et par conséquent la toxicité, tout en gardant impé-
rativement la dose requise au volume cible, voire de
permettre une augmentation de la dose. Les oncologues
radiothérapeutes ont pu bénéfi cier de 2 évolutions
majeures : une évolution technologique avec les progrès
de l’imagerie, permettant un ciblage plus précis des
tumeurs et une protection plus large des tissus sains ;
et une meilleure compréhension de la radiobiologie
des cancers prostatiques.
Cet article a pour objectif de décrire les modalités, les
résultats et les toxicités de la radiothérapie conforma-
tionnelle par modulation d’intensité (RCMI) dans les
cancers prostatiques localisés. Nous ferons également
le point sur les récents essais d’hypofractionnement en
RCMI ainsi que sur le développement de la radiothérapie
stéréotaxique.
Place et principes de la RCMI
dans les cancers de la prostate localisés
Plusieurs études ont confi rmé le bénéfi ce, en radio-
thérapie externe normofractionnée, de délivrer de
hautes doses d’irradiation (de l’ordre de 76 à 81 Gy)
dans les cancers prostatiques localisés, afi n d'obtenir
points forts
highlights
»
La radiothérapie conformationnelle par modulation d’intensité
(RCMI) autorise une escalade de dose (78 à 80 Gy) au volume
cible prostatique, réalisant une amélioration du contrôle
biochimique et une réduction des toxicités rectales et urinaires,
comparativement à la radiothérapie conformationnelle standard.
»
La précision de la RCMI repose sur l’imagerie embarquée,
qui contrôle la position de repères fi duciaires, qui sont des
marqueurs radio-opaques implantés en intraprostatique.
»
Des essais d’hypofractionnement sont en cours, qui valideront
l’équivalence, voire la supériorité thérapeutique, de doses par
fractions supérieures ou égales à 3 Gy dans les cancers de la
prostate localisés.
»
La radiothérapie hypofractionnée en conditions stéréotaxiques
est en plein essor, montrant d’excellents profi ls de tolérance et
d’effi cacité dans les cancers prostatiques à bas risque.
Mots-clés : Radiothérapie conformationnelle par modulation
d’intensité (RCMI) − Radiothérapie guidée par l’image − Cancers
prostatiques localisés − Hypofractionnement − Radiothérapie
stéréotaxique.
Intensity-Modulated Radiation Therapy (IMRT) allows
to deliver high-doses to the prostate, leading to better
local control, while minimizing rectal and urinary
toxicities, compared to standard conformational
radiotherapy.
The accuracy of IMRT is based on daily on-board-
imaging, controlling the position of intraprostatic
fi ducial markers.
Hypofractionated schedules are currently tested
in phase II-III to validate the therapeutic ratio of
hypofractionation, as well as its safety profi le.
Stereotactic body radiation therapy, giving 5 fractions
of 7,25 Gy over 5 days, has shown excellent local
control and low toxicities in the setting of low-risk
prostate cancer.
Keywords: Intensity-Modulated Radiation Therapy −
Image-guided radiotherapy − Localized prostate
cancer − Hypofractionation − Stereotactic body
radiation therapy.

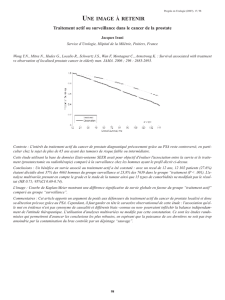
Figure. Distribution des isodoses de traitement en RCMI, en coupes axiale et sagittale, exprimée en
pourcentage de la dose totale prescrite : l’hétérogénéité de dose acceptable est de plus ou moins 10 %.
La dose prescrite doit couvrir 95 % du volume cible prévisionnel. La coupe axiale montre un des 3 grains
d’or intraprostatiques.
Correspondances en Onco-Urologie - Vol. III - no 3 - juillet-août-septembre 2012
9797
Avancées technologiques et nouveaux fractionnements
une amélioration significative du contrôle local et
biochimique (1-3).
Cette escalade de dose requiert une précision accrue,
rendue possible par les techniques de la RCMI et
ses récents développements comme l’arc therapy
dynamique ou la tomothérapie hélicoïdale.
La RCMI permet ainsi la délivrance de hautes doses
d’irradiation sur des volumes cibles complexes en
respectant au mieux les contraintes de doses sur les
organes adjacents, à savoir la paroi rectale et vésicale.
Les mouvements du collimateur multilame (MLC)
permettent l’obtention de multiples faisceaux ayant
chacun une inhomogénéité contrôlée, soit par des
techniques de multifaisceaux statiques successifs
(“step and shoot”), soit par une approche de mouve-
ments continus des lames (MLC dynamique, “sliding
window”). La distribution de dose est établie à partir
d’algorithmes informatiques dits de “calcul inverse”
qui optimisent le profil d’intensité de chacun des
faisceaux pour respecter les contraintes déterminées
par le radiothérapeute.
Les volumes cibles, la prostate et les vésicules séminales
ont préalablement été délinéés par l’oncologue radio-
thérapeute. Des expansions en 3D de 5 mm sont prises
autour de ces volumes, pour obtenir le volume cible
prévisionnel (Planned Target Volume [PTV]), sauf au
niveau de l’interface prostate-rectum, où cette marge
est de 3 mm, afi n de décroître les doses reçues par le
rectum (fi gure).
Les contraintes de doses habituelles requièrent de
ne pas dépasser 53 % de la paroi rectale ou vésicale
recevant une dose supérieure à 47 Gy (V47 Gy < 53 %).
Habituellement, entre 5 et 8 faisceaux coplanaires d’une
énergie de photons de 10 à 18 MV sont utilisés pour la
RCMI des cancers prostatiques.
Récemment, cette technique de RCMI a été améliorée
grâce à l’irradiation de l’ensemble du volume tumoral
lors d’une seule rotation continue du bras de l’accélé-
rateur, réduisant ainsi de manière sensible le temps de
traitement. Cette technique d’irradiation volumique
modulée (VMAT) ne diff ère de la RCMI convention-
nelle que par son mode de délivrance. La réduction
importante du temps d’irradiation off re la possibilité
de traiter plus de patients et d’associer plus facilement
une technique de contrôle des faisceaux par imagerie
(Image-Guided Radiotherapy [IGRT]) pour limiter les
risques liés aux mouvements du patient ou de la tumeur
au cours de la séance d’irradiation.
En effet, du fait de variations anatomiques pouvant
survenir en cours d’irradiation – le remplissage
vésical ou rectal par exemple –, ces modalités
d’irradiation de haute précision incluent toutes un
dispositif de guidage par imagerie. Cette imagerie
permet, notamment grâce à l’implantation de repères
fiduciaires radio-opaques intraprostatiques tels que
les grains d’or, l’obtention d’une précision de reposi-
tionnement quotidienne millimétrique sur la prostate.
Des images tomodensitométriques (TDM) tridimen-
sionnelles peuvent ainsi être obtenues en position
de traitement à chaque séance. Plusieurs solutions
ont été proposées, comme l’utilisation de capteurs
plans intégrés au bras de l’accélérateur permettant
en une rotation de reconstruire des images 3D (Cone-
Beam Computerized Tomography [CBCT]), l’ajout de
tubes de rayons X sur un bras de l’accélérateur
linéaire (on-board imaging), ou l’intégration d’un
scanner et d’un accélérateur en une seule machine
(tomothérapie).

dossier thématique
Radiothérapie du cancer
de la prostate localisé
Correspondances en Onco-Urologie - Vol. III - no 3 - juillet-août-septembre 2012
9898
Principaux résultats après une RCMI
Les résultats des séries de patients traités en RCMI,
exprimés en termes de survie sans rechute bio chimique,
sont présentés dans le tableau I. La série la plus
importante est celle de M.J. Zelefsky et al. portant
sur 561 patients et rapportant des taux de contrôle
biochimique à 8 ans, selon les diff érents critères de
l’American Society for Therapeutic Radiology and
Oncology (ASTRO), du Memorial Sloan-Kettering
Cancer Center (MSKCC) et de Phoenix, de 85 à 89 %
pour le groupe favorable, de 76 à 78 % pour le groupe
à risque intermédiaire, et de 67 à 72 % pour le groupe
à haut risque.
Globalement, avec des suivis allant de 5 à 10 ans, la survie
sans rechute du PSA est de 85 à 100 % pour le groupe
de faible risque, de 76 à 85 % pour les patients de risque
intermédiaire, et de 62 à 82 % pour ceux à haut risque.
En termes de tolérance, la RCMI diminue considéra-
blement le risque de toxicités tardives. Un taux consé-
quent de 25 % de rectites radiques de grade 2 était
observé après l’administration d’une dose de 78 Gy en
radiothérapie conformationnelle classique selon une
étude de phase III du MD Anderson Cancer Center (17).
En revanche, sur l’ensemble des études publiées sur la
RCMI, les taux de rectite radique de grades 2 et 3 selon
l’échelle du NCI-CTCAE sont respectivement de 2 à 9 %
et de 1 % – une toxicité de grade 3 nécessitant le recours
à une photocoagulation laser ou à une transfusion pour
rectorragie. Aucune étude n’a rapporté de toxicités
gastro-intestinales de grade 4 (tableau II).
Sur le plan de la toxicité urinaire, 9 % des patients ont
décrit une urétrite chronique de grade 2 dans un délai
médian de 14 mois, et 3 %, une sténose urétrale de
grade 3 ayant nécessité une dilatation (4). De façon
intéressante, Z.A. Alicikus et al. retrouvent en analyse
multivariée une corrélation entre l’intensité des toxicités
aiguës et la fréquence de survenue d’une toxicité
tardive : une toxicité aiguë de grade 2 est prédictive
du développement d’une toxicité tardive de grade
supérieur ou égal à 2.
Essais d’hypofractionnement en RCMI
La plupart des essais cliniques proposant des schémas
de fractionnement altérés suggèrent que le ratio α/β du
cancer prostatique est d’environ 1,5 Gy, ce qui refl ète une
forte sensibilité à la dose par fraction de la prostate (10).
Cette valeur est inférieure à celle décrite pour la toxicité
tardive des organes adjacents, tels que le rectum ou
la vessie. Cela implique, du moins en théorie, que les
schémas hypofractionnés présentent un avantage radio-
biologique pouvant accroître le ratio thérapeutique. Par
ailleurs, sur le plan économique, l’hypofractionnement
permet une réduction de la durée totale de traitement,
avec des étalements de 4 à 5 semaines versus 8 semaines
en fractionnement classique de 2 Gy.
Plusieurs essais randomisés sont actuellement en
cours pour valider l’équivalence, voire la supériorité
thérapeutique, des schémas hypofractionnés en RCMI.
Dans les premiers résultats publiés, la tolérance aiguë
semble tout à fait superposable à celle des schémas
normofractionnés. Le tableau III présente les plus
récentes publications des essais de phase II-III de ces
nouveaux schémas hypofractionnés en RCMI.
Tableau II. Toxicités tardives gastro-intestinales et génito-urinaires après une RCMI.
Références
Nombre
depatients
Recul
(années)
Toxicités tardives
gastro-intestinales
(%)
Toxicités tardives
gastro-urinaires
(%)
M.J. Zelefsky et al. (4)
561
8
Gr 2 = 1,5
Gr 3 ≤ 1
Gr 4 = 0
Gr 2 = 9
Gr 3 = 3
O. Cahlon et al. (5)
478
53
Gr 2 = 3
Gr 3 < 1
Gr 2 = 13
Gr 3 ≤ 3
I.M. Lips et al. (9)
331
47
Gr 2 = 9
Gr 3 = 1
Gr 2 = 21
Gr 3 = 4
Z.A. Alicikus et al. (6)
170
10
Gr 2 = 2
Gr 3 = 1
Gr 2 = 11
Gr 3 = 5
Tableau I. RCMI dans les cancers de la prostate localisés : résultats de survie sans rechute biochimique.
Références
Nombre
de
patients
Blocage
androgénique
(%)
Dose
totale
(Gy)
Recul
(années)
Survie
sans récidive
biochimique (%)
M.J. Zelefsky etal. (4)
561
BR : 33,5
RI : 52
HR : 92
81
8
BR : 85
RI : 76
HR : 72
O. Cahlon et al. (5)
478
BR : 66
86,4
5
BR : 98
RI : 85
HR : 70
Z.A. Alicikus etal. (6)
170
BR : 54
(3 mois)
81
10
BR : 81
RI : 78
HR : 62
J.M. Martin et al. (7)
259
BR : 13,6
RI : 11
HR : 45,9
79,8
5
BR : 88,4
RI : 76,5
HR 77,9
K. Takeda et al. (8)
141
RI : 67
HR : 92
80
5
RI : 100,0
HR : 82,2
BR : bas risque ; RI : risque intermédiaire ; HR : haut risque.

Correspondances en Onco-Urologie - Vol. III - no 3 - juillet-août-septembre 2012
9999
Avancées technologiques et nouveaux fractionnements
L’analyse intermédiaire de l’essai anglais CHHiP, de
D. Dearnaley et al., ne montre aucune diff érence signi-
fi cative en termes de toxicités aiguës entre les bras
expérimentaux hypofractionnés et le bras standard.
Les taux d'eff ets tardifs à 2 ans, cotés selon l’échelle
du RTOG, sont également très rassurants, puisque le
taux de toxicités digestives tardives est de 3,6 % dans
le groupe traité à 60 Gy (3 Gy/fraction ; 4 semaines),
de 1,4 % dans le groupe traité à 57 Gy (3 Gy/fraction ;
3,8 semaines) et de 4,3 % dans le groupe en fraction-
nement classique (2 Gy/fraction ; 7,4 semaines) [11].
La phase III randomisée de S. Arcangeli et al. (12) a
actualisé en 2012 les résultats de survie sans progression
biologique et sans récidive locale avec un recul de
5 ans chez 168 patients classés à haut risque, ce qui
confi rme l’équivalence thérapeutique des 2 types de
fractionnement de 80 Gy en 8 semaines et de 62 Gy
en 5 semaines. Cependant, il est retrouvé une petite
augmentation non signifi cative de la survie sans rechute
biologique dans le bras hypofractionné, sans diff érence
en termes de récidive locale ou méta statique.
En conclusion, la radiothérapie hypofractionnée en
RCMI est une option thérapeutique pour les patients
présentant un cancer prostatique localisé, avec des
tolérances aiguës et tardives comparables à celles
des schémas en fractionnement classique ; il faudra
attendre les résultats de futurs essais de phase III pour
en confi rmer le bénéfi ce thérapeutique éventuel.
Développement de la radiothérapie
enconditions stéréotaxiques
La radiothérapie en conditions stéréotaxiques est en
pleine expansion pour l’irradiation des cancers de la
prostate à risque faible ou intermédiaire. Les schémas
de fractionnement sont typiquement de 5 fractions
de 7 à 10 Gy, tirant avantage du ratio α/β bas du cancer
de la prostate. Les critères d’inclusion retenus dans
les essais de phase II sont les stades T1c–T2a, un PSA
inférieur ou égal à 10, un score de Gleason de 6 ou 7,
et un score IPPS bas inférieur à 20. Dans l’étude de
phase II publiée en 2009 par C.R. King et al. et actua-
lisée en 2011, utilisant la technologie CyberKnife® (15),
la dose totale est de 36,25 Gy en 5 fractions de 7,25 Gy
sur 5 jours consécutifs. Une étude similaire de A.J. Katz
et al. (16) a comparé 2 doses d’irradiation de 35 et de
36,25 Gy, cherchant à mettre en évidence un eff et-
dose. Aucune diff érence signifi cative n’a été observée
entre les 2 groupes. Dans toutes les études, les profi ls
de toxicités aiguës et tardives sont excellents, compa-
rables à ceux observés en RCMI (de l’ordre de 5 % de
toxicité urinaire de grade 3). Le contrôle biochimique
rapporté est de 97,5 % à 4 ans pour A.J. Katz et al., et
de 93 % à 5 ans pour C.R. King et al.
De nombreuses publications additionnelles avec des
durées de suivi variables et des catégories de risque
plus élevées confortent la tolérance et l’effi cacité de
l’irradiation stéréotaxique. Si la place de la radio thérapie
en conditions stéréotaxiques des cancers de la prostate
reste pour l’instant minoritaire en France, elle devrait
augmenter rapidement avec l’implémentation d’accé-
lérateurs dédiés à cette technique.
Conclusion
L’avènement de la RCMI a permis une escalade de
dose jusqu’à 80 Gy et plus dans l’irradiation des
cancers prostatiques, améliorant le contrôle local
tout en diminuant les toxicités rectales tardives. La
précision accrue de la RCMI est fondée sur l’imagerie
embarquée 3D, qui permet le contrôle quotidien de la
position du volume cible prostatique grâce aux repères
fi duciaires implantés en intraprostatique. Les nouveaux
schémas d’hypo fractionnement délivrant des doses
supérieures ou égales à 3 Gy en RCMI ont déjà montré
des profi ls de tolérance acceptables et une effi cacité
satisfaisante. Les futurs essais de phase III, notamment
de radiothérapie en conditions stéréotaxiques,
devraient confirmer ces résultats prometteurs. ■
Tableau III. Essais d’hypofractionnement hautes doses en RCMI.
Références
Nombre
de
patients
Dose totale/
fractionnement/
étalement
Toxicités tardives
(%)
Contrôle
biochimique
(%)
D. Dearnaley et al.
(11)
457
Phase III
Bras 1 : 74 Gy/37fr/
7,4sem.
Bras 2 : 60 Gy/20 fr/
4 sem.
Bras 3 : 57 Gy/19 fr/
3,8 sem.
À 2 ans
Bras 1 GI = 4,3
Bras 2 = 3,6
Bras 3 = 1,4
S. Arcangeli et al.
(12)
168
Phase III ;
patients à haut risque
80 Gy/40 fr/8 sem.
62 Gy/20 fr/5 sem.
À 3 ans
GI grade 2 = 17
GU grade 2 = 14
À 6 ans
80
V. Fonteyne et al.
(13)
113
Phase II
56 Gy/16 fr/4 sem.
À 3 ans
GI ≥ grade 2 = 8
GU ≥ grade 2 =13
À 3 ans
94
P.A. Kupelian et al.
(14)
770
Phase II
70 Gy/28 fr/5,5 sem.
À 5 ans
GI grade 2 = 4,5
GU grade 2 = 5,2
À 5 ans
BR 95
RI 85
HR 68
Fr : fraction ; GI : toxicités gastro-intestinales ; GU : toxicités gastro-urinaires.
Références

dossier thématique
Radiothérapie du cancer
de la prostate localisé
Correspondances en Onco-Urologie - Vol. III - no 3 - juillet-août-septembre 2012
100100
1. Beckendorf V, Guerif S, Le Prisé E et al. 70 Gy versus 80 Gy in
localized prostate cancer : 5-year results of GETUG 06 rando-
mized trial. Int J Radiat Oncol Biol Phys 2011;80:1056-63.
2. Dearnaley DP, Sydes MR, Graham JD et al. Escalated-dose
versus standard-dose conformal radiotherapy in prostate
cancer: First results from the MRC RT01 randomised controlled
trial. Lancet Oncol 2007;8:475-87.
3. Zietman AL, DeSilvio ML, Slater JD et al. Comparison
of conventional-dose versus high-dose conformal radia-
tion therapy in clinically localized adenocarcinoma of the
prostate: a randomized controlled trial. JAMA 2005;294:
1233-9.
4. Zelefsky MJ, Chan H, Hunt M et al. Long-term outcome of
high dose intensity modulated radiation therapy for patients
with clinically localized prostate cancer. J Urol 2006;176:1415-9.
5. Cahlon O, Zelefsky MJ, Shippy A et al. Ultra-high dose
(86.4 Gy) IMRT for localized prostate cancer : toxicity and
biochemical outcomes. Int J Radiat Oncol Biol Phys 2008;
71:330-7.
6.
Alicikus ZA, Yamada Y, Zhang Z et al. Ten-year outcomes
of high-dose, intensity-modulated radiotherapy for localized
prostate cancer. Cancer
2011;117:1429-37.
7. Martin JM, Bayley A, Bristow R et al. Image guided dose esca-
lated prostate radiotherapy: still room to improve. Radiation
Oncology
2009;4:50.
8. Takeda K, Takai Y, Narazaki K et al. Treatment outcome of
high-dose image-guided intensity-modulated radiotherapy
using intraprostate fi ducial markers for localized prostate
cancer at a single institute in Japan. Radiat Oncol 2012;7:105.
9. Lips IM, Dehnad H, van Gils CH et al. High-dose intensity-
modulated radiotherapy for prostate cancer using daily fi ducial
marker-based position verifi cation: acute and late toxicity in
331 patients. Radiat Oncol 2008;3:15.
10. Miralbell R, Roberts SA, Zubizarreta E et al. Dose-
fractionation sensitivity of prostate cancer deduced from
radiotherapy outcomes of 5,969 patients in seven international
institutional datasets: α/β = 1.4 (0.9-2.2) Gy. Int J Radiat Oncol
Biol Phys 2012;82:e17-24.
11.
Dearnaley D, Syndikus I, Sumo G et al. Conventional versus
hypofractionated high-dose intensity-modulated radiotherapy
for prostate cancer: preliminary safety results from the CHHiP
randomised controlled trial. Lancet Oncol 2012;13:43-54.
12.
Arcangeli S, Strigari L, Gomellini S et al. Updated results
and patterns of failure in a randomized hypofractionation
trial for high-risk prostate cancer. Int J Radiat Oncol Biol Phys
2012. [Epub ahead of print]
13. Fonteyne V, Soete G, Arcangeli S et al. Hypofractionated
high-dose radiation therapy for prostate cancer: long-term
results of a multi-institutional phase II trial. Int J Radiat Oncol
Biol Phys 2012. [Epub ahead of print]
14. Kupelian PA, Willoughby TR, Reddy C et al. Hypofractionated
intensity-modulated radiotherapy (70 Gy at 2.5 Gy per fraction)
for localized prostate cancer: Cleveland Clinic experience. Int
J Radiat Oncol Biol Phys 2007;68:1424-30.
15.
King CR, Brooks JD, Gill H et al. Stereotactic body radio-
therapy for localized prostate cancer: interim results of a
prospective phase II clinical trial. Int J Radiat Oncol Biol Phys
2009;73:1043-8.
16. Katz AJ, Santoro M, Ashley R et al. Stereotactic body
radiotherapy for organ-confi ned prostate cancer. BMC Urol
2010;10:1.
17. Storey MR, Pollack A , Zagars G et al . Complications from
radiotherapy dose escalation in prostate cancer: preliminary
results of a randomized trial. Int J Radiat Oncol Biol Phys 2000;
48:635-42.
Références
Au sommaire du prochain numéro
Dossier thématique : Dossier thématique :
Radiothérapie dans le cancer de la prostate
Deuxième partie
Coordonné par Philippe Beuzeboc
»» Grains d’or intraprostatiques, une aide à la radiothérapie du cancer de la prostate
D. Pontvert
»» Curiethérapie - J.M. Hannoun-Levi
»» Thérapeutiques focales en traitement de rattrapage des cancers de la prostate
traités par radio- ou curiethérapie - A. Gelet
»» Conduite à tenir en postopératoire en cas d’atteinte des berges et de la capsule
S. Supiot
»» Prise en charge d’une récidive locale après chirurgie
A. Tolédano
» Parution en décembre» Parution en décembre
1
/
5
100%