Composition de la matière : Air, atomes et molécules

Thème 1 : Organisation et transformation de la matière
Chapitre 3. Compositionde la matière
Question du chapitre :Comment la structure de la matière qui nous entoure permet elle
d'expliquer les transformations physiques et chimiques ?
I. Compositionet propriété de l'air
1. La composition de l'air
Activité 1. L'air qui nous entoure
L'atmosphère terrestre est constituée d'un mélange de gaz.
L'air qui nous entoure est composé de :
78% de diazote (N2),
21% de dioxygène (O2)
1% d'autres gaz (dont du dioxyde de carbone, de
la vapeur d'eau, de l'ozone etc.)
A l'échelle microscopique l'air est constitué de particules
extrêmement petites : les molécules.
Dans un corps pur, toutes les molécules sont identiques.
Dans un mélange (comme l'air qui nous entoure), il y a plusieurs
sortes de molécules.
Une molécule est constituée d'un assemblage d'atomes.
Le dioxygène est une molécule résultant de l'association de deux atomes
d'oxygène. La molécule de diazote est formée de deux atomes d'azote.
2. La pression de l'air
Activité 2. Le principe de la pression de l'air
On peut diminuer le volume de l’air. Il est
donc compressible
On peut augmenter le volume de l’air. Il est
donc expansible
L'air (et tous les gaz) appuient, poussent sur
toutes les surfaces avec lesquelles ils sont en
contact : on dit qu’ils exercent une pression.
La pression atmosphérique se mesure grâce à
un baromètre ou lorsqu’un gaz est enfermé
dans une enceinte (récipient
hermétiquement clos) avec un manomètre.
L’unité légale de pression est le Pascal (Pa) ou
l’hectopascal (hPa) 1hPa = 100 Pa. Mais Le

bar (bar) 1bar = 100 000 Pa est couramment utilisé.
La pression de l'air atmosphérique est directement liée à la météorologie (présence de dépression
ou d'anticyclone).
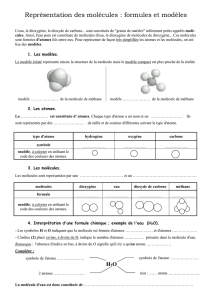
II. Les atomes : constituants des molécules
Activité 3. Des atomes, des molécules et des réactions chimiques
1. Les atomes
Toute la matière qui nous entoure est constituée de particules microscopiques que l’on appelle
atomes regroupés parfois sous forme de molécules.
Chaque atome est représenté par un symbole qui commence toujours par une majuscule, parfois
suivie d’une minuscule. La première lettre correspond souvent à la première lettre du nom.Les
atomes peuvent être modélisés par des sphères de couleurs différentes (modèle atomique).
Tableau des atomes à retenir, leur symbole et leur modèle atomique
Atome
Symbole
Modèle
Hydrogène
H
Oxygène
O
Carbone
C
Azote
N
Soufre
S
Chlore
Cl
Tous les atomes existants sont regroupés dans un tableau périodique des éléments qui regroupe à
ce jour 118 atomes différents.
NB : Vous pouvez installer l'appli "tableau périodique des éléments de Merck" sur vos Smartphones
2. Les molécules
Des atomes peuvent se « rassembler » pour former des molécules.
Une molécule est représentée par une formule chimique qui indique :
Les différentes sortes d’atomes dont elle est constituée (chaque atome est représenté par
son symbole)
Le nombre de chaque atome (grâce au nombre placé en indice après chaque atome)
Exemple : la molécule d’eau a pour formule chimique H2O
Le symbole H indique que la molécule d’eau est constituée d’atomes
d’hydrogène et son indice indique qu’il y en a deux.
Le symbole O indique qu’elle est aussi constituée d’atomes d’oxygène mais
l’absence d’indice indique qu’il n’y a qu’un atome.

III. Les atomes lors d'une réaction chimiques ou physique
1. Transformation chimique
Exercice n°1. Equilibrer des équations chimiques
Au cours d'une transformation chimique, les atomes des réactifs se recombinent pour former les
molécules des produits et il y a une conservation des atomes : il y a le même nombre et le même
type d'atomes au début et à la fin de la réaction.
L’équation de réaction est un moyen de représenter une transformation chimique.
Chaque substance (réactif ou produits) est représentée par sa formule chimique.
Pour traduire la conservation des atomes dans l'écriture de l'équation, il faut parfois ajouter des
nombres devant les formules des molécules. L'équation est alors équilibrée.
Exemple de la combustion du carbone
Lors d’une transformation chimique la masse totale des réactifs disparus est égale à la masse
totale de produits formés. Il ya donc conservation de la masse totale.
2. Dissolution
Au cours d'une dissolution, le nombre de molécules reste le même et la masse totale ne change
pas. Le volume total reste généralement inchangé.
Exemple de la dissolution du sel dans l'eau
3. Changements d'états
Activité 4. Organisation des molécules et état de l'eau
Un solide est compact et ordonné : les molécules sont rapprochées et fortement liées entre
elles.
Un liquide est compact et désordonné : les molécules sont rapprochées mais peu liées
entre elles. Elles peuvent glisser les unes sur les autres.

Dans un gaz, les molécules sont dispersée et désordonnées (elles sont animées de
mouvements).
Cette organisation des molécules permet d'expliquer pourquoi les gaz sont compressibles tandis
que les solides et les liquides sont incompressibles. Et pourquoi les gaz et les liquides n’ont pas de
forme propre tandis que les solides ont une forme propre.
Au cours d'un changement d'état :
les liaisons entre les molécules changent et donc le volume varie.
la masse se conserve car le nombre de molécules reste le même.
les molécules gardent la même forme et la même taille.
Phys/Chimie. Thème 1. Chapitre 3. Composition de la matière
A la fin de ce chapitre je dois...
Savoir
Savoir faire
Utiliser le vocabulaire du chapitre
Connaitre la composition et les propriétés
moléculaires de l'air.
Connaitre les principaux atomes, leur symbole et
leur modélisation.
Connaitre la disposition des molécules selon l'état
de la matière.
Savoir expliquer une transformation physique et
chimique d'un point de vue moléculaire.
Réaliser un diagramme circulaire
Réaliser une graphique avec Excel
Représenter des molécules courantes.
Représenter les molécules lors d'une
transformation chimiques.
Equilibrer le bilan d'une réaction chimique
1
/
4
100%