caracterisation morphologique, phenotypique et moleculaire des

UNIVERSITE PARIS-EST CRETEIL VAL DE MARNE
FACULTE DE MEDECINE DE CRETEIL
<<<<><><><><><><>>>>
ANNEE 2015-2016 N° 2016UPEC1026
THESE
POUR LE DIPLOME D'ETAT
DE
DOCTEUR EN MEDECINE
Discipline : Anatomie et cytologie pathologiques
------------
Présentée et soutenue publiquement le 1er juin 2016
à CRETEIL (PARIS EST CRETEIL)
------------
Par Ariane LECLAIRE ALIRKILICARSLAN
Née le 01/04/1987 à PARIS 14
-------------
CARACTERISATION MORPHOLOGIQUE, PHENOTYPIQUE
ET MOLECULAIRE
DES LOCALISATIONS CUTANEES
DE LYMPHOME T ANGIO-IMMUNOBLASTIQUE
PRESIDENT DE THESE : LE CONSERVATEUR DE LA
M. Philippe GAULARD BIBLIOTHEQUE UNIVERSITAIRE
DIRECTEUR DE THESE :
M. Nicolas ORTONNE
Signature du Cachet de la bibliothèque
Président de thèse universitaire

2
Remerciements
A Monsieur le Docteur Nicolas Ortonne qui a dirigé ce travail. Je le remercie
chaleureusement pour son encadrement, son enseignement et sa disponibilité tout
au long de cette étude.
A Monsieur le Professeur Philippe Gaulard, qui me fait l’honneur d’être président du
jury et pour son enseignement hors pair de l’hématopathologie.
A Madame le Docteur Anaïs Pujals pour sa participation active au projet et son
accueil durant mon semestre en pathologie moléculaire.
A Madame le Docteur Saskia Oro qui a accepté de participer au jury.
A Madame le Docteur Aurélie Dupuy, sans qui cette étude n’aurait pu aboutir. Merci
pour ton aide précieuse depuis le tout début, en particulier concernant les
manipulations, les réponses à mes nombreuses questions et la relecture.
A toute l’équipe, médecins, techniciens et secrétaires du service de pathologie de
l’hôpital Henri Mondor ainsi qu’à Madame Nadine Martin, de l’équipe INSERM.
A toutes les personnes travaillant au sein des services d’anatomie pathologique dans
lesquels je suis passée durant mon internat et qui ont participé d’une manière ou
d’une autre à ma formation : hôpital de Montfermeil, hôpital Robert Debré, hôpital
Foch, hôpital René Huguenin, hôpital de la Pitié-Salpétrière, hôpital Henri Mondor et
hôpital Cochin.
A mes parents, mon mari, toute ma famille et mes proches pour leur soutien sans
faille durant ces longues années d’étude.
A mon fils qui a partagé mes bras avec l’ordinateur durant les premières semaines
de sa jeune vie pour la rédaction de cette thèse.
Remerciements à la Société Française de Dermatologie (SFD) pour l’octroi d’une
bourse de recherche au titre de l’appel d’offre 2015.
A Madame le Professeur Béatrice Vergier et Monsieur le Docteur Alistair Robson
pour nous avoir fourni des échantillons de l’étude.

3
Table des matières
I. Introduction ......................................................................................................... 6
A. Le lymphome T angio-immunoblastique : clinique ..................................... 6
B. Pronostic et traitement .................................................................................. 6
C. Les manifestations cutanées du lymphome T angio-immunoblastique.... 7
D. Un lymphome T dérivé des cellules TFH...................................................... 7
E. Caractéristiques histologiques et immuno-histochimiques des LAI sur
biopsie ganglionnaire ........................................................................................... 8
F. Caractéristiques histologiques et immuno-histochimiques des LAI sur
biopsie cutanée ................................................................................................... 13
G. Développement de lymphome B au cours du LAI ..................................... 13
H. Caractéristiques moléculaires des LAI ...................................................... 14
1. Clonalité et cytongénétique ......................................................................... 14
2. Mutations..................................................................................................... 14
II. Objectifs de l’étude .......................................................................................... 21
III. Matériel et Méthodes ...................................................................................... 22
A. Patients ......................................................................................................... 22
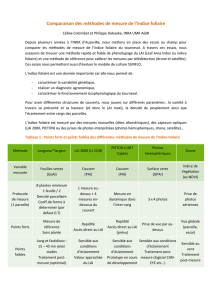
B. Etudes histopathologique et immunohistochimique ................................ 24
C. Etude moléculaire ........................................................................................ 27
1. Les conditions de PCR ................................................................................ 28
2. Les conditions de RT-qPCR ........................................................................ 29
D. Corrélations entre le groupe morphologique, l’expression des marqueurs
TFH dans la peau et la présence d’une mutation RHOA ou IDH2 ................... 32
IV. Résultats ......................................................................................................... 33
A. Analyse histopathologique ......................................................................... 33
B. Analyse phénotypique ................................................................................. 38
C. Analyse moléculaire .................................................................................... 45
1. Mutation RHOA p.Gly17Val ......................................................................... 45
2. Mutations IDH2 p.Arg172Lys et p.Arg172Ser ............................................. 46
D. Comparaison entre le profil morphologique, l’expression des marqueurs
TFH en immunohistochimie et la présence d’une mutation RHOA p.Gly17Val
50
V. Discussion ........................................................................................................ 54
VI. Bibliographie ................................................................................................... 61

4
Table des illustrations (Figures)
Figure 1 – Modèle théorique de la pathogénèse du LAI------------------------------------ 11
Figure 2 – Mutation RHOA p.Gly17Val dans le lymphome T angio-immunoblastique
-------------------------------------------------------------------------------------------------------- 18
Figure 3 - Mutations de RHOA dans les lymphomes T périphériques ------------------ 19
Figure 4 - Diagramme de flux de l'étude--------------------------------------------------------- 23
Figure 5 - Mise au point de la technique de PCR allèle spécifique pour la recherche
de mutation RHOA p.Gly17Val -------------------------------------------------------------- 30
Figure 6 - Principe de la PCR allèle spécifique ARMS -------------------------------------- 31
Figure 7 – Exemples d’infiltrats cutanés des groupes morphologiques 1, 2 et 3 ----- 36
Figure 8 - Exemples de localisations cutanées de LAI ------------------------------------- 37
Figure 9 - Phénotypes de localisations cutanées de LAI ----------------------------------- 41
Figure 10 - Lymphome composite de type lymphome B diffus à grandes cellules
EBV+ associé à une localisation cutanée de LAI --------------------------------------- 42
Figure 11 - Lymphome composite de type lymphome B plasmocytoïde associé à une
localisation cutanée de LAI ------------------------------------------------------------------- 43
Figure 12 – Localisation cutanée de LAI avec immunohistochimie IDH2 R172K
positive --------------------------------------------------------------------------------------------- 44
Figure 13 - Résultats de PCR RHOA p.Gly17Val sur échantillons cutanés et
ganglionnaires ------------------------------------------------------------------------------------ 49

5
Table des illustrations (Tableaux)
Tableau 1 - Diagnostics différentiels du lymphome T périphérique, sans autre
spécificité (PTCL, NOS) ................................................................................................................. 12
Tableau 2 - Résultats des études de prévalence de la mutation RHOA p.Gly17Val
dans les lymphomes T périphériques ...................................................................................... 20
Tableau 3 – Résumé des résultats de l’étude phénotypique ................................................. 35
Tableau 4 - Résultats de l’étude immunohistochimique pour l’ensemble des cas
étudiés et en fonction du groupe morphologique de lymphome T angio-
immunoblastique ................................................................................................................................ 40
Tableau 5 - Résultats de l’analyse moléculaire pour la recherche de mutation RHOA
p.Gly17Val (paires peau/ganglion chez le même patient et biopsies cutanées
seules) ..................................................................................................................................................... 47
Tableau 6 - Résultats de l’analyse moléculaire cas par cas pour la recherche de
mutation RHOA p.Gly17Val, IDH2 p.Arg172Lys et p.Arg172Ser ............................... 48
Tableau 7 - Comparaison entre l’expression des marqueurs TFH en
immunohistochimie et la présence d’une mutation RHOA p.Gly17Val .................... 52
Tableau 8 – Comparaison entre l’expression des marqueurs TFH et la présence
d’une mutation RHOA ou IDH2 en fonction du groupe morphologique................... 53
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
1
/
66
100%