thématique D Tolérance en transplantation

Le Courrier de la Transplantation - Volume V - n
o
2 - avril-mai-juin 2005
98
DOSSIER
thématique
* Institut d’immunologie médicale, Université Libre
de Bruxelles, faculté de médecine, hôpital Érasme,
Bruxelles.
Transplantation d’îlots et tolérance
"
C. Beuneu*
À
l’heure actuelle, à peu près
170 millions de personnes
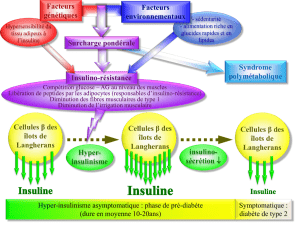
souffrent de diabète parmi la population
mondiale (estimation en 2000). La pré-
valence de cette pathologie va croissant,
et on estime que ce nombre dépassera
les 360 millions en 2030 (1). Environ
5 à 10 % des patients adultes sont affec-
tés par le diabète de type 1, appelé
anciennement diabète insulinodépen-
dant. Cette forme très sévère de diabète
est due à la destruction auto-immune
des cellules β,responsables de la sécré-
tion d’insuline au sein des îlots pancréa-
tiques. Les patients souffrant de diabète
de type 1 sont dépendants à vie d’un
traitement à l’insuline. Bien que ces
traitements en constante évolution
offrent une maîtrise de plus en plus effi-
cace de la glycémie, ils ne permettent
pas de prévenir complètement les com-
plications chroniques et dégénératives
associées au développement de la
pathologie. Seule la transplantation de
pancréas ou d’îlots pancréatiques puri-
fiés permet une réelle restauration du
contrôle métabolique de la glycémie. La
simplicité et la nature beaucoup moins
invasive de la transplantation d’îlots lui
confèrent l’avantage très intéressant
d’une morbidité considérablement
réduite par rapport à celle occasionnée
par la transplantation d’un pancréas
entier.
Les premières transplantations cliniques
d’îlots isolés remontent aux années
1970-1980. Ces greffes ne rencontrèrent
à l’époque que très peu de succès,
puisque seul un patient atteint de diabète
non auto-immun devint indépendant de
l’insuline et le resta pendant dix mois
(2, 3). Ces échecs étaient principale-
ment dus à la qualité des îlots transplan-
tés, leur purification à partir de pancréas
entiers posant nombre de difficultés. Le
développement d’une technique de pré-
paration automatisée permettra les pre-
mières transplantations réussies dans les
années 1990 (4, 5). Toutefois, ce n’est
qu’à partir de 2000, quand paraît le rap-
Tolérance en
transplantation
d’organe
Coordinateur : A. Le Moine,
Institut d’immunologie médicale,
Université Libre de Bruxelles,
Gosselies,
département de néphrologie,
hôpital Érasme, Bruxelles, Belgique
(La question de la tolérance en transplantation : mythe ou réalité ?
A. Le Moine (page 86)
(Induction de tolérance : de la délétion à la régulation
F.S. Benghiat, A. Le Moine (page 89)
"Transplantation d’îlots et tolérance - C. Beuneu
(L’induction de tolérance en greffe d’organe : bientôt une réalité ?
V. Donckier, R.Troisi, A. Le Moine
(page 106)
(Mesure de l’alloréactivité au moyen des tétramères de complexes
majeurs d’histocompatibilité - D. Klestadt
(page 113)

Le Courrier de la Transplantation - Volume V - n
o
2 - avril-mai-juin 2005
99
DOSSIER
thématique
port du groupe d’Edmonton, considéré
comme le travail de référence dans le
domaine, que la transplantation d’îlots
est réellement considérée comme une
piste intéressante pour le traitement du
diabète (6). À la suite de ces résultats,
de nombreux centres ont développé des
protocoles cliniques de transplantation
d’îlots.
Cette technique, très prometteuse pose
encore de nombreux problèmes qui
limitent drastiquement son application.
La qualité des préparations, bien
qu’ayant beaucoup évolué, reste relati-
vement peu satisfaisante (encadré I).
De plus, la plupart des patients nécessi-
tent la transplantation des îlots prove-
nant de deux à quatre pancréas pour
atteindre l’indépendance à l’insuline
(encadré II). Cela représente évidem-
ment un inconvénient majeur étant
donné la disponibilité réduite en pan-
créas. D’autre part, des complications
sont liées à la procédure en elle-même
[risques de thromboses] (6), à la locali-
sation dans le foie des îlots (stéatose
hépatique, perte progressive de fonction
des îlots) et à l’immunosuppression (7).
LES TRAITEMENTS
IMMUNOSUPPRESSEURS
Chez la majorité des patients diabé-
tiques de type 1, la glycémie peut être
contrôlée de manière relativement satis-
faisante. De ce fait, la nécessité absolue
d’un traitement immunosuppresseur
pour permettre la survie de la greffe,
avec tous les effets négatifs qui y sont
associés, est plus difficilement accep-
table que pour les autres greffes d’or-
ganes. Le rapport risque/bénéfice d’un
tel acte pour le patient doit être scru-
puleusement évalué. Le protocole
d’Edmonton a permis de montrer qu’un
traitement immunosuppresseur spéci-
fique, dépourvu de glucocorticoïdes
diabétogènes, induisait clairement une
meilleure survie des greffes (6).
Cependant, les glucocorticoïdes ne sont
pas les seuls immunosuppresseurs
potentiellement délétères pour les
Àl’heure actuelle, les techniques de préparation d’îlots à
partir de pancréas ne sont pas standardisées entre les dif-
férents centres pratiquant la transplantation d’îlots. On ne
peut donc que décrire quelques étapes communes à la majo-
rité des protocoles de greffe d’îlots. L’isolement des îlots doit
se faire le plus rapidement possible, de préférence dans les
huit heures suivant le prélèvement. Le pancréas est tout
d’abord digéré par une solution de collagénase dépourvue
d’endotoxines. Cette phase de digestion est effectuée dans un
automate permettant la récupération et le lavage des îlots
isolés en continu, au fur et à mesure de la digestion. Cette
automatisation a permis l’obtention de préparations d’îlots
plus riches et de meilleure qualité. Le digestat est ensuite
séparé sur un gradient de densité, afin d’obtenir une fraction
fortement enrichie en îlots de Langerhans. Toutefois, ces pré-
parations contiennent toujours une très forte proportion de
cellules non endocrines contaminantes. Il est intéressant de
noter que même dans le protocole de référence publié par le
groupe d’Edmonton (6), la pureté des préparations en cellules β
est de 24 % en moyenne, avec un maximum de 52 %.
Les îlots sont injectés au patient le plus souvent par voie por-
tale et vont se nicher dans le parenchyme hépatique. On
considère à l’heure actuelle que la masse minimale d’îlots à
transplanter pour obtenir l’indépendance à l’insuline d’un
patient diabétique est de 10 000 îlots/kg. Il est la majorité
du temps absolument nécessaire de combiner les îlots de deux
pancréas, voire plus, pour obtenir cette masse critique. Deux
possibilités ont été explorées : soit les îlots sont mis en cul-
ture, afin de permettre la combinaison de plusieurs prépara-
tions, soit le patient subit des greffes répétées juqu’à avoir
dépassé ce seuil minimal.
PROCÉDURE DE TRANSPLANT
PROCÉDURE DE TRANSPLANTA
ATION D’ÎLO
TION D’ÎLOTS
TS
ET PRÉP
ET PRÉPARA
ARATION DES SUSPENSIONS
TION DES SUSPENSIONS
Un des problèmes majeurs rencontrés lors de la greffe
d’îlots est l’importance de la perte de fonction du greffon
dans les heures suivant la transplantation. En effet, seul un
très faible pourcentage des îlots injectés sont encore
capables de produire de l’insuline après la greffe. De nom-
breux phénomènes liés à la procédure de greffe et à l’envi-
ronnement du greffon pourraient expliquer cette perte de
fonction.
En particulier, le foie présente un environnement immunitaire
particulier de par sa fonction, sa vascularisation et sa com-
position cellulaire. On peut donc penser que cet environne-
ment conditionne le devenir des îlots greffés. D’autre part, la
faible pression partielle locale en oxygène pourrait également
être délétère.
Il a été montré que l’injection de préparations pancréatiques
dans la circulation sanguine induit l’activation de la coagula-
tion et, par conséquent, celle du complément. En effet, plu-
sieurs types cellulaires expriment le facteur tissulaire au sein
des préparations d’îlots, gâchette de la coagulation in vivo :
les cellules d’îlots,mais surtout les cellules ductales,cellules
épithéliales contaminantes, présentes dans toutes les prépa-
rations. Il a été suggéré que l’activation de la coagulation
résulte en la destruction de nombreux îlots, expliquant ainsi
la perte de fonction, du moins en partie.
Quoi qu’il en soit, il paraît fondamental de cerner les diffé-
rents phénomènes impliqués dans la perte de fonction immé-
diate, de façon à déterminer des traitements permettant de
réduire le nombre d’îlots nécessaires pour obtenir l’indépen-
dance à l’insuline.
PERTE DE FONCTION IMMÉDIA
PERTE DE FONCTION IMMÉDIATE DU GREFFON
TE DU GREFFON
ENCADRÉ I
ENCADRÉ I
ENCADRÉ II
ENCADRÉ II

Le Courrier de la Transplantation - Volume V - n
o
2 - avril-mai-juin 2005
DOSSIER
thématique
100
patients diabétiques. Le FK506 présente
un risque diabétogène non négligeable.
La rapamycine également, quand elle
est employée en combinaison avec le
FK506 (8). Les inhibiteurs de calcineu-
rine, de façon générale, interfèrent avec
une fonction normale des cellules β(9,
10). De plus, ces inhibiteurs augmentent
très fortement le risque d’insuffisance
rénale, déjà très élevé chez les patients
diabétiques. D’autre part, les effets
indésirables classiques des immunosup-
presseurs sont lourds, avec des risques
élevés de dyslipidémie, d’hypertension,
de neuropathie, mais aussi d’infections
et de cancers. Tout cela restreint grande-
ment l’indication de la transplantation
d’îlots.
Une étude réalisée sur les patients trans-
plantés aux États-Unis s’est intéressée à
la mortalité de patients diabétiques
(avec une fonction rénale préservée)
ayant reçu une greffe d’îlots, comparati-
vement à celle de patients dont le diabète
présentait un même niveau de difficulté
de contrôle, mais qui étaient toujours
sur liste d’attente pour cette même
transplantation. Les résultats assez
inquiétants montrent une augmentation
de la mortalité parmi les patients greffés
(11). Cette mortalité accrue est suppo-
sée être liée à l’immunosuppression. On
peut légitimement penser qu’aujour-
d’hui les seuls patients ayant intérêt à la
transplantation sont ceux qui ont subi
ou qui envisagent une autre greffe, très
probablement rénale, et donc déjà sous
thérapie immunosuppressive, ou bien
ceux dont le diabète ne peut pas être
efficacement contrôlé et qui souffrent
d’épisodes hypoglycémiques sévères et
récurrents.
Si l’on veut élargir le champ d’applica-
tion de la greffe d’îlots aux enfants ou
aux personnes dont le diabète est bien
régulé par les thérapies classiques, il
paraît crucial de développer des straté-
gies alternatives permettant l’induction
de tolérance aux greffes d’îlots. La tolé-
rance s’entend ici comme l’acceptation
définitive de la greffe en l’absence d’im-
munosuppression continue et en mainte-
nant l’immunocompétence du patient
greffé. De nombreuses pistes sont étu-
diées à l’heure actuelle, qui permettront
un jour sans doute de diminuer, voire de
supprimer l’emploi d’immunosuppres-
seurs. Cet article résume les principaux
essais d’induction de tolérance réalisés
dans des modèles animaux et donnant
des résultats prometteurs.
L’INDUCTION DE TOLÉRANCE
La tolérance est l’absence de réponse
immunitaire agressive et destructrice à
un antigène. Afin de maintenir l’intégrité
du soi et d’éviter les maladies auto-
immunes, le système immunitaire doit
pouvoir induire une tolérance au soi. On
distingue habituellement la tolérance
périphérique de la tolérance centrale. La
tolérance centrale est obtenue par la
délétion clonale des lymphocytes T auto-
réactifs au niveau du thymus. La tolérance
périphérique est maintenue par le
contrôle dans les tissus périphériques de
l’activité des lymphocytes T autoréactifs
ayant échappé à la sélection thymique.
Ce contrôle met en jeu des mécanismes
d’induction d’anergie, de délétion et de
régulation. Celle-ci est en partie effec-
tuée par une population de cellules parti-
culières appelées lymphocytes T régula-
teurs. Ces lymphocytes régulateurs (de
phénotype CD4+ CD25+) permettent de
maintenir l’homéostasie des lympho-
cytes T et de réguler l’activité des T auto-
réactifs ayant échappé à la sélection
négative. Ils ont en outre été montrés de
nombreuses fois comme étant les vec-
teurs de tolérance lors de transplantations
dans des modèles animaux. Les princi-
pales stratégies d’induction de tolérance
aux greffes s’inspirent de ces systèmes
de tolérance naturelle ou tentent de les
stimuler.
Dans le cas de la greffe d’îlots, le défi
posé présente une particularité par rap-
port aux autres types de greffe. En effet,
la greffe est faite dans un contexte
d’auto-immunité préexistante qui sup-
pose l’existence d’un pool de lympho-
cytes T autoréactifs, et pose la question
de la récidive possible de la maladie. On
sait effectivement que ce risque est réel
et peut participer au rejet d’îlots trans-
plantés chez des patients atteints de dia-
bète de type 1 (12-14). Il y a donc ici
deux aspects à considérer concernant
l’induction de la tolérance.
Blocage des signaux costimulateurs/
induction d’une tolérance périphérique
Une des stratégies les plus étudiées à
l’heure actuelle est la modulation de
l’activité alloréactive des cellules du
système immunitaire en périphérie.
L’approche la plus intéressante consiste
à traiter brièvement le receveur avec des
anticorps ou des molécules inhibant les
signaux de costimulation des lympho-
cytes T. Ce type de traitement met en
jeu des phénomènes de délétion et
d’anergie, mais aussi de régulation par
les fameux lymphocytes T régulateurs.
Il faut noter que les expériences sui-
vantes ont été réalisées chez des
modèles de receveurs non “auto-
immuns”, où le diabète était induit par
un toxique chimique.
La costimulation des lymphocytes T
passe par l’interaction de molécules
membranaires situées à la surface des T
avec leurs ligands exprimés à la surface
des cellules présentatrices d’antigènes
(CPA). Les deux voies principales
sont les suivantes : CD28/B7 et
CD154/CD40, avec CD28 et CD154
exprimés par le T et B7 et CD40 expri-
més par la CPA (figure 1). La première
voie peut être bloquée par la protéine
de fusion CTLA4-Ig, et la deuxième par
un anticorps monoclonal anti-CD154
(tableau I, figure 2). Le blocage simul-
tané des deux voies de costimulation

Le Courrier de la Transplantation - Volume V - n
o
2 - avril-mai-juin 2005
101
DOSSIER
thématique
permet d’augmenter de façon syner-
gique la durée de vie de l’allogreffe (15,
16). D’autre part, le traitement de souris
avec l’une de ces molécules permet
d’obtenir une tolérance aux îlots trans-
plantés si elles sont utilisées en combi-
naison avec une transfusion de cellules
du donneur (17-19). Cette transfusion
consiste en une injection de cellules
spléniques du donneur au moment de la
greffe.
D’autres voies de costimulation, identi-
fiées plus récemment, peuvent aussi
représenter des cibles intéressantes (20)
[figures 1 et 2]. La durée de vie des
greffes d’îlots peut être prolongée par
une intervention sur la voie
Programmed Death 1 (PD1)/PDL-1 -
PDL-2, ou sur la voie Inducible
Costimulator (ICOS)/B7RP-1. PD1 est
un récepteur qui transmet un signal
costimulateur négatif. La stratégie est
donc ici légèrement différente, puisqu’il
s’agit non plus d’empêcher un signal
d’activation, mais de stimuler un récep-
Figure 1. Les différentes voies cibles de l’induction de tolérance aux greffes d’îlots.
Sur ce graphique sont représentées les différentes voies d’activation ou de costimulation qui ont à l’heure
actuelle été testées pour l’induction de tolérance aux îlots transplantés dans des modèles murins ou de pri-
mates. Sont représentées les molécules présentes à la surface des cellules présentatrices d’antigène (CPA)
et leurs ligands présents à la surface des T activés ou non. Des flèches indiquent la nature de ces signaux.
Des symboles sont indiqués quand le signal favorise l’activation du lymphocyte T, des symboles quand
le signal transmis est négatif et induit un état non activé du lymphocyte.
Activation (régulation
des signaux de transduction)
Prolifération
Production
de cytokines
Différenciation
Th1/Th2
Anergie =
inhibition
de la prolifération
et de la production
de cytokines
Apoptose
Induction de T
régulateurs ?
Adhésion,
interaction
cellules/cellules,
"homing"
Activation
Signal 1
Costimulation
Signal 2
Lymphocyte T CPA
+
+
+
-
+
CD45RB
CD154
LFA-1
ICOS
TCR CMH
CD40
B7RP-1
CD28
CTLA4 B7-2
B7-1
PD1 PDL-1
PDL-2
Nature de la molécule Type fonctionnel Fonction
CTLA4-Ig Protéine de fusion : Antagoniste Bloque la costimulation par la voie CD28/B7 :
domaine extramembranaire se fixe sur B7-1 et B7-2 de manière préférentielle
de CTLA4 + fragment Fc d’une IgG à CD28 (compétition)
Anti-CD154 Anticorps monoclonal Antagoniste Bloque la costimulation par la voie CD40/CD154
PDL-1-Ig Protéine de fusion : domaine Agoniste Induit la costimulation négative en stimulant
extramembranaire de PDL-1 le récepteur PD1
+ fragment Fc d’une IgG
Anti-CD3-immunotoxine Protéine de fusion : fragment F(Ab) Antagoniste Provoque la déplétion des lymphocytes T
d’un anticorps anti-CD3 naïfs ou mémoires
+ toxine diphtérique
Anti-CD45RB Anticorps monoclonal Antagoniste Bloque l’activation : provoque l’inhibition
de l’expression de CD45RB à la surface des T,
affecte la transduction des signaux d’activation
Anti-LFA-1 Anticorps monoclonal Antagoniste Bloque la fixation de LFA-1 sur son récepteur :
affecte l’adhésion, l’interaction cellule/cellule, le homing
Anti-ICOS Anticorps monoclonal Antagoniste Bloque la costimulation par la voie ICOS/B7RP-1
cIL-2-Fc Protéine de fusion : IL-2 (active) Agoniste Induit l’apoptose des T activés par mort cellulaire active
+ fragment Fc d’une IgG en stimulant le récepteur à l’IL-2
cmIL-15-Fc Protéine de fusion : IL-15 mutante Antagoniste Induit l’apoptose des T activés par mort cellulaire
(inactive) + fragment Fc d’une IgG passive en bloquant le récepteur à l’IL-15 et en empêchant
la transmission de signaux protecteurs de l’apoptose
Tableau I. Description des différentes molécules utilisées dans les protocoles d’induction de tolérance.
-
+

Le Courrier de la Transplantation - Volume V - n
o
2 - avril-mai-juin 2005
102
DOSSIER
thématique
teur (PD1) induisant un signal négatif.
Dans ces expériences, la protéine de
fusion agoniste PDL-1-Ig seule ne per-
mettait d’augmenter que faiblement la
durée de vie des greffons. En revanche,
en synergie avec un traitement anti-
CD154, elle permettait une survie des
îlots transplantés à long terme (21).
Le même résultat est obtenu lors du blo-
cage d’ICOS en combinaison avec le
CTLA4-Ig ou l’anti-CD154, ou encore
la rapamycine (22).
D’autres molécules importantes expri-
mées par les lymphocytes T peuvent
être bloquées et amener des résultats
très intéressants. C’est le cas de la pro-
téine transmembranaire CD45RB et de
la molécule d’adhésion LFA-1. Le trai-
tement transitoire par un anticorps
monoclonal dirigé contre l’une ou
l’autre de ces molécules permet d’induire
une tolérance spécifique du donneur
dans des souris transplantées (23, 24).
Toutefois, c’est en combinaison avec
une thérapie anti-CD154 que ces molé-
cules sont les plus efficaces (25, 26). Le
double traitement anti-LFA-1 + anti-
CD154 induit en effet une tolérance
dominante et forte, spécifique du don-
neur, dans les souris receveuses d’îlots
(25). Cette tolérance est transférable à
un receveur immunodéficient suggérant
l’intervention de cellules régulatrices.
Elle est dominante et ne peut être abolie
par une forte stimulation consistant en
l’injection de cellules spléniques de
type donneur.
LES ESSAIS CHEZ LES PRIMATES
Des approches similaires ont été testées
chez des primates. Par exemple, l’em-
ploi de CTLA4-Ig, en plus d’une immu-
nosuppression sans glucocorticoïdes,
permet d’augmenter la survie de la greffe
(27). De même, le traitement par anti-
CD154 prolonge la durée de vie des
greffes d’îlots, mais sans induction de
tolérance, et un traitement continu est
nécessaire pour éviter le rejet (28).
L’utilisation d’anti-CD3-immunotoxine
donne des résultats intéressants,
puisque même si, là non plus, la tolé-
rance n’est pas induite, un traitement
transitoire permet la survie de la greffe
pour plus d’une année (29).
GREFFER DANS UN CONTEXTE
D’AUTO-IMMUNITÉ
L’induction de tolérance vis-à-vis
d’îlots transplantés chez des patients
atteints de diabète de type 1 pose un
double problème. Le contexte d’auto-
immunité préexistante représente effec-
tivement un défi supplémentaire à celui
de la réaction allogénique classique-
ment rencontrée dans toutes les greffes.
On peut légitimement penser que si la
greffe n’est pas détruite par cette der-
nière, elle le sera par récidive de la
maladie diabétique (12-14). Chez le
patient diabétique, il préexiste effective-
ment un pool de lymphocytes T auto-
réactifs et de T mémoires déjà primés
pour la destruction des cellules β. Or,
s’il faut des signaux puissants pour
induire une réaction allogénique à un
antigène nouveau, des lymphocytes T
précédemment activés peuvent être
réactivés beaucoup plus facilement. Il
est donc à craindre que les stratégies
permettant l’obtention d’une tolérance
dans des receveurs non auto-immuns
soient beaucoup moins efficaces chez
des patients diabétiques. C’est ce que
l’on observe chez les souris diabétiques
NOD (non obese diabetic, souche
dont les femelles développent sponta-
nément un diabète auto-immun) chez
qui peu des stratégies citées ci-dessus
Figure 2. Mode d’action
des différentes molécules
utilisées pour induire la
tolérance.
Sur la base simplifiée de la
figure 1, sont reportés les dif-
férents inhibiteurs ou ago-
nistes utilisés pour bloquer
ou stimuler différentes voies
démontrées importantes dans
l’induction de tolérance aux
greffes d’îlots. Chaque molé-
cule est accompagnée d’une
flèche indiquant son action
inhibitrice (flèche rouge
comprenant un -) ou stimu-
latrice (flèche verte compre-
nant un +).
Activation
(régulation
des signaux
de transduction)
Adhésion,
interaction
cellules/cellules,
"homing"
Prolifération
des T activés
Protection
contre l'apoptose
Apoptose
des T
activés
cIL-2-Fc
cmIL-15-Fc
Anti-LFA-1
Anti-CD154
Anti-ICOS
Anti-CD45RB
PDL-1-lg
CTLA4-lg
Activation
Signal 1
Costimulation
Signal 2
Lymphocyte T
+
+
+
-
+
CD45RB
CD154
ICOS
TCR
CD28
PD1
LFA-1
IL-15-R
IL-2-R
+
+
 6
6
 7
7
 8
8
1
/
8
100%