C Préservation de la fertilité chez l’adulte jeune atteint d’un cancer

154 | La Lettre du Cancérologue • Vol. XVIII - n° 3 - mars 2009
DOSSIER THÉMATIQUE
Cancers de l’adolescent
Préservation de la fertilité
chez l’adulte jeune atteint
d’un cancer
Fertility preservation in young cancer patients
P. This*
* Institut Curie, Paris ; Centre de
la Femme, hôpital de Versailles, Le
Chesnay.
C
hez l’adulte jeune confronté à un cancer, les
conséquences des traitements sur la ferti-
lité existent et peuvent entrer en jeu dans
la stratégie thérapeutique lorsque plusieurs options
sont discutées. Certaines méthodes de préservation
de la fertilité peuvent être proposées aujourd’hui. Il
existe actuellement une demande croissante d’in-
formation chez ces jeunes patients (il peut s’agir
d’un ou d’une adolescent[e], d’un adulte jeune, en
couple ou célibataire) et leurs proches à laquelle les
oncologues doivent pouvoir répondre.
Conséquences des traitements
La chirurgie compromet la fertilité lorsque le cancer
intéresse directement les organes génitaux, testi-
cules chez le garçon, utérus et/ou ovaires chez la
fille. La chirurgie des cancers gynécologiques est
malheureusement souvent mutilante, que ce soit
celle des cancers du col de l’utérus, celle des cancers
de l’endo mètre ou celle des cancers épithéliaux de
l’ovaire.
La radiothérapie, lorsqu’elle intéresse l’utérus, a un
effet délétère sur la fertilité : ses conséquences à la
fois morphologiques et dynamiques induiront des
difficultés de nidation, des fausses couches spon-
tanées précoces et des anomalies d’implantation
du placenta.
L’effet délétère de la chimiothérapie sur le fonction-
nement des gonades est bien établi : chez la femme,
il dépend de l’âge, du type de chimiothérapie, des
doses prescrites et de la susceptibilité individuelle.
En pratique, le risque d’aménorrhée chimio-induite
est approximativement de 10 % vers 35 ans, de 40 %
vers 40 ans, et il augmente ensuite rapidement,
pour atteindre 70 à 80 % vers 45 ans (1). Même
en cas d’impact faible chez les femmes vraiment
jeunes, âgées de moins de 30 ans, celles-ci reste-
ront confrontées de toute façon à une ménopause
prématurée.
Après un cancer du sein, un traitement antihormonal
peut être prescrit pendant plusieurs années : le tamoxi-
fène est l’hormonothérapie adjuvante de référence
chez les jeunes femmes. Cet antiestrogène, inducteur
de l’ovulation et tératogène, nécessite le recours à
une contraception : en pratique, une contraception
locale par préservatifs ou un dispositif intra-utérin
au cuivre.
Les agonistes de la LH-RH sont également parfois
prescrits à la suite d’un cancer du sein soit isolément,
soit en association avec le tamoxifène : ils provoquent
un état d’insuffisance ovarienne profonde mais tran-
sitoire ; à l’arrêt du traitement, la fonction ovarienne
reprend.
Préservation de la fertilité
Depuis la publication des recommandations récentes
de l’ASCO, les oncologues doivent connaître les diffé-
rentes méthodes utilisables, leur efficacité et leurs
limites (1).
Chez le garçon
Chez le garçon pubère ou l’adulte jeune, la préser-
vation de la fertilité repose essentiellement sur la
congélation de sperme. La production de sperma-
tozoïdes est qualitativement et quantitativement
correcte à partir de 13 ou 14 ans (2), donc la congé-
lation de sperme est techniquement possible chez
l’adolescent pubère et en période péripubertaire, bien
que la qualité du sperme soit parfois déjà altérée au

La Lettre du Cancérologue • Vol. XVIII - n° 3 - mars 2009 | 155
Résumé
Les traitements du cancer peuvent compromettre la fertilité de l’adulte jeune, qu’il s’agisse de la chirurgie, de
la radiothérapie ou de la chimiothérapie. Les patients doivent être informés de ces conséquences. Chez la jeune
femme, les effets de la chimiothérapie dépendent de l’âge, des composés utilisés et des doses.
Parmi les méthodes envisageables pour préserver la fertilité figurent la congélation de sperme chez l’homme, et,
chez la femme, la transposition ovarienne, la chirurgie conservatrice pour les cancers gynécologiques, la congé-
lation d’embryon, d’ovocyte, d’ovaire, et la coprescription d’agonistes de la LH-RH pendant la chimiothérapie.
Certaines méthodes sont encore expérimentales.
Mots-clés
Agoniste de la LH-RH
Congélation d’ovaires
Congélation d’ovocyte
Don d’ovocyte
Préservation
de la fertilité
Highlights
In young patients, cancer thera-
pies may have some impact on
fertility. Information about these
outcomes must be disclosed to
these young patients. Surgery
and uterine radiation therapy
may compromise fertility.
Chemotherapy may induce
ovarian failure, which depends
on age, type and dose of cyto-
toxic agents.
Sperm cryopreservation must
be proposed to young men. A
variety of techniques of fertility
preservation were recently
proposed in young women
namely ovarian transposi-
tion, conservative gynecologic
surgery, embryo cryo-preserva-
tion, oocyte cryo-preservation,
ovarian tissue cryo-preser-
vation, and co-prescription
of LH-RH analogues during
chemotherapy. Some of these
techniques are still experi-
mental.
Keywords
Fertility preservation
LH-RH analogues
Oocyte cryo-preservation
Oocyte donation
Ovarian tissue
cryo-preservation
moment du diagnostic. En pratique, cette méthode
suppose une aptitude physique et psychologique
et le soutien de l’entourage. Un accompagnement
psychologique du jeune est souvent nécessaire. Rare-
ment, on proposera un recueil des spermatozoïdes
par ponction épididymaire ou biopsie testiculaire.
Chez la fille
Méthodes de préservation de la fertilité ◆
“stricto sensu”
Quelques méthodes existent, dont certaines sont
encore expérimentales :
Congélation embryonnaire. ➤ Cette méthode est
largement utilisée aujourd’hui en assistance médi-
cale à la procréation (AMP) et repose sur le principe
de la fécondation in vitro (FIV) : une stimulation de
l’ovulation à l’aide de gonadotrophines permet le
développement sur les ovaires de plusieurs follicules
contenant des ovocytes. Lorsque ceux-ci sont arrivés à
maturité, l’ovulation est déclenchée. Trente-six heures
après l’injection, les follicules sont ponctionnés sous
échographie et les ovocytes recueillis, mis en culture
avec le sperme du conjoint.
Chez les femmes ayant un cancer, le principe de
la méthode consiste à effectuer cette FIV avant la
chimiothérapie et à congeler les embryons obtenus.
À distance des traitements, ceux-ci seront décongelés
et réimplantés dans l’utérus de la patiente.
Très peu d’équipes ont osé à ce jour proposer cette
méthode à des femmes chez lesquelles un cancer
venait d’être diagnostiqué (3) : pour les cancers du
sein, la principale réticence concerne les conséquences
d’une élévation importante des taux d’estrogènes sur
la maladie mammaire. De plus, la congélation d’em-
bryons ne concerne que des couples constitués et se
heurte à des difficultés évidentes, à la fois pratiques
(accès rapide à la FIV sans retarder les traitements)
et psychologiques…
Congélation d’ovocytes.
➤
Dans ce cas, ce sont
les ovocytes obtenus que l’on congèle, sur le même
principe que la congélation de sperme avant les trai-
tements infertilisants chez l’homme. Cette méthode
est en théorie applicable aux jeunes femmes céli-
bataires. À distance des traitements, les ovocytes
seront décongelés et mis en culture avec les sperma-
tozoïdes du futur conjoint. Bien que séduisante, cette
méthode est encore expérimentale. La congélation,
puis la décongélation des ovocytes posent d’impor-
tants problèmes techniques, et le rendement de cette
méthode est très faible.
Cryo-préservation du tissu ovarien.
➤Le principe
consiste à prélever, avant la chimiothérapie, du cortex
ovarien, voire un ovaire, sous cœlioscopie. Les frag-
ments ovariens sont analysés au microscope, préparés,
puis congelés. À distance des traitements, ils seront
décongelés, puis réimplantés chez la patiente. Selon
les cas, l’ovulation peut survenir spontanément, ou
après stimulation, et la fécondation peut être naturelle
ou obtenue par FIV. À ce jour, quelques grossesses ont
été obtenues chez des femmes ayant reçu des chimio-
thérapies pour des maladies hématologiques (4, 5).
Bien que les résultats en aient été immédiatement
médiatisés, soulignons qu’il s’agit d’une technique
encore expérimentale qui soulève de nombreuses
questions d’ordre technique mais aussi éthique.
Aujourd’hui, la cryo-préservation du tissu ovarien est
de plus en plus souvent proposée, notamment aux
très jeunes femmes (de moins de 30 ans) avant des
traitements “fortement infertilisant” dans le cadre
d’hémopathies malignes, de sarcomes ou de tumeurs
ovariennes borderline, dans l’espoir que les techniques
de greffes seront au point lorsque ces jeunes femmes
souhaiteront devenir mères. En revanche, chez les
jeunes femmes atteintes de cancer du sein, cette
méthode n’est pas indiquée, car l’ablation d’un ovaire
risquerait d’être plus délétère que les conséquences
de la chimiothérapie adjuvante sur la fertilité.
Enfin, notons qu’il existe un risque au moins théorique
de réintroduction de cellules malignes imposant de
rechercher, au moment de la greffe, une maladie rési-
duelle sur le greffon par des techniques très spéciali-
sées (immuno-histochimie, biologie moléculaire).
Prescription d’agonistes de la LH-RH pendant
➤
la chimiothérapie. Le principe de cette méthode
consiste à “mettre les ovaires au repos” pendant la
chimiothérapie : on espère ainsi “protéger” le capital
folliculaire ovarien.
Bien qu’en pratique la coprescription d’agonistes de
la LH-RH et d’une chimiothérapie soit parfois effec-
tuée “empiriquement” par certains oncologues (6),
son effet sur la préservation de la fertilité est loin
d’être établi (1), et ne peut se concevoir que dans
le cadre d’essais cliniques.

156 | La Lettre du Cancérologue • Vol. XVIII - n° 3 - mars 2009
Préservation de la fertilité chez l’adulte jeune atteint d’un cancer
DOSSIER THÉMATIQUE
Cancers de l’adolescent
Adaptation des traitements ◆
Une autre manière de préserver la fertilité consiste
à mettre au point des traitements moins toxiques
pour les ovaires ou moins mutilants, mais cette
“désescalade thérapeutique” ne doit pas conduire à
sous-traiter les patientes et doit être soigneusement
évaluée. Ainsi, en cas de cancers gynécologiques,
il est parfois possible de s’orienter vers un traite-
ment moins lourd : pour le cancer du col de l’utérus
débutant, trachélectomie élargie amputant le col de
l’utérus, mais préservant une partie du corps utérin ;
pour le cancer de l’endomètre débutant (stade I),
résection hystéroscopique de l’endomètre suivie
d’une hystérectomie de clôture, une fois le projet de
grossesse mené ; pour le cancer épithélial de l’ovaire
débutant (stade IA), ablation d’un seul ovaire (7). Ces
méthodes encore expérimentales ont des indications
extrêmement limitées et ne peuvent se concevoir
que dans des équipes hautement spécialisées, après
un bilan très complet et une information éclairée de
la jeune femme ou du couple.
Transposition des ovaires
◆
Enfin, la transposition des ovaires, permettant
d’exclure ceux-ci des champs d’irradiation, est
parfois proposée. Si elle permet le maintien d’une
fonction hormonale, sa place dans la préservation
de la fertilité doit se discuter selon le geste utérin
associé : rappelons qu’en France la légalisation de
la “gestation pour autrui” fait actuellement l’objet
d’un débat éthique. La conservation d’un capital
ovarien est donc problématique chez les femmes
hystérectomisées.
Restauration de la fertilité
Une grossesse est-elle “envisageable” sur le plan
oncologique est la première question qui se pose.
Ainsi, après un cancer du sein traité, la plupart des
équipes recommandent de respecter un “délai de
sécurité” d’environ 2 à 3 ans, car le risque de réci-
dive est plus élevé dans les suites immédiates du
diagnostic. De toute façon, il est recommandé d’at-
tendre au moins une année après la dernière cure
de chimiothérapie, et deux mois après l’arrêt du
tamoxifène afin d’éviter tout risque tératogène.
Chez les femmes ayant une insuffisance ovarienne
avérée ou une ménopause précoce, le seul moyen
d’obtenir une grossesse est le don d’ovocytes.
En France, ses conditions sont extrêmement
réglementées (8).
La donneuse (une jeune femme, déjà mère, de moins
de 36/37 ans) va subir une stimulation hormonale
selon un protocole “classique” de FIV. Ses ovocytes
sont prélevés et mis en contact avec les spermato-
zoïdes du conjoint de la receveuse. Le ou les embryons
obtenus sont replacés dans l’utérus de la receveuse qui,
en France, doit nécessairement avoir l’âge de procréer,
donc moins de 42/43 ans. Chez les femmes en insuf-
fisance ovarienne complète, une courte substitution
hormonale est nécessaire jusqu’au relais placentaire.
Le don est anonyme et gratuit. En France, les listes
d’attente sont très longues en raison du manque de
donneuses. Actuellement, certaines femmes y ont
recours dans d’autres pays d’Europe, où l’accès au
don d’ovocytes est plus simple et plus rapide (environ
quelques mois). Enfin, lorsqu’à l’insuffisance ovarienne
avérée s’associe, chez le conjoint, une anomalie très
sévère du sperme, reste l’accueil d’embryon : c’est le
transfert à un couple stérile d’un ovule fécondé venant
d’un autre couple ayant eu recours aux techniques
d’AMP et ayant abandonné son projet parental. Cette
possibilité peut désormais être proposée aux couples
présentant une double infertilité.
Conclusion
La congélation de sperme doit être systématique-
ment proposée aux garçons.
Malgré des avancées récentes prometteuses, la
préservation de la fertilité féminine reste encore
expérimentale, qu’il s’agisse de la congélation d’em-
bryons, d’ovocytes ou d’ovaire, ou de la mise au repos
des ovaires par des agonistes de la LH-RH pendant
la chimiothérapie (9) [tableau].
Dès aujourd’hui, il nous faut anticiper cette nouvelle
demande de nos jeunes patients, apprendre à mieux
les informer, engager des collaborations avec des
équipes d’AMP sensibilisées à ces thématiques,
rédiger des référentiels adaptés et mettre en place
des enregistrements prospectifs. ■
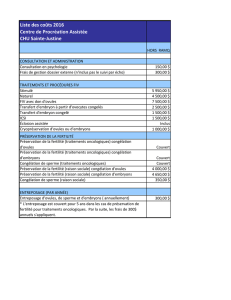
Tableau. Taux de succès des méthodes de préservation de la fertilité chez la femme (9).
Option Femmes qui obtiendront une grossesse (%)
Cycles spontanés
(Acceptation du risque d’infertilité)
5 à 28 %, 3 à 6 ans après le traitement
(dépend de l’âge de la femme)
Agonistes de la LH-RH pendant la chimiothérapie
(expérimental)
Non connu
Congélation d’embryons 20 à 30 % par transfert de 3 embryons
Congélation d’ovocytes 3 % par ovocyte décongelé
Congélation d’ovaire Quelques grossesses rapportées
Don d’ovocytes 40 à 50 % par transfert de 2 ou 3 embryons
1. Lee SJ, Schover LR, Partridge AH
et al. American Society of
Clinical Oncology recomman-
dations on fertility preservation
in cancer patients. J Clin Oncol
2006;24(18):2917-31.
2. Klapouszczak D, Bertozzi-
Salamon AI, Grandjean H,
Arnaud C. Fertility preservation in
adolescent cancer patients. Bull
Cancer 2007;94(7):636-46.
3. Oktay K, Buryuk E, Libertella N,
Akar M, Rosenwaks Z. Fertility
preservation in breast cancer
patients: a prospective controlled
comparison of ovarian stimulation
with tamoxifen and letrozole for
embryo cryopreservation. J Clin
Oncol 2005;23(19):4347-53.
4. Meirow D, Levron J, Eldar-
Geva T et al. Pregnancy after
transplantation of cryopreserved
ovarian tissue in a patient with
ovarian failure after chemo-
therapy. New Engl J Med 2005;
353(3):318-21.
5. Donnez J, Dolmans MM,
Demylle D et al. Livebirth after
orthotopic transplantation of
cryopreserved ovarian tissue.
Lancet 2004;364:1405-10.
6. Blumenfeld Z, Eckman A.
Preservation of fertility and
ovarian function and minimiza-
tion of chemotherapy-induced
gonadotoxicity in young women
by GnRH-a. J Natl Cancer Inst
Monogr 2005;34:40-3.
7. Bonnier P, Morice P. Dossier
thématique : Préservation de la
fertilité dans les cancers du col et
de l’ovaire. La Lettre du Gynéco-
logue 2006(315):19-36.
8. Vernaeve V, Reis Soares S,
Budak E, Bellver J, Remohi J,
Pellicer A. [Clinical factors asso-
ciated with the outcome of oocyte
donation]. Gynecol Obstet Fertil
2007;35(10):1015-23.
9. Lobo RA. Potential options for
preservation of fertility in women.
N Engl J Med 2005;353(1):
64-73.
Références
bibliographiques
1
/
3
100%